某学习小组利用下列装置探究氯气和氨气之间的反应,其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气和氨气的反应装置。请回答下列问题: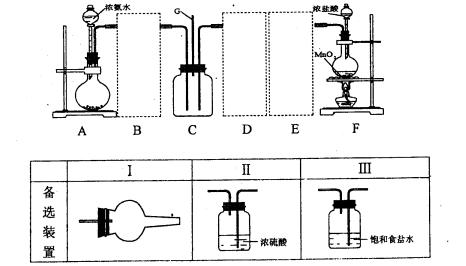
(1)装置A中烧瓶内的固体可选用 。
a.烧碱 b.生石灰. c.二氧化硅 d.五氧化二磷
(2)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择并将编号填入下列空格。B ;D ;E (填编号)。装置I中需要的试剂是 。
(3)写出F中发生反应的离子方程式: 。
(4)装置C内出现白烟并在容器内壁凝结,鉴定该固体中的阳离子的操作步骤: 。
(5)该装置连接后尚存在的缺陷是: 。
“稳定性二氧化氯溶液”是淡黄色透明液体,广泛应用于食品卫生等领域的杀菌消毒。ClO2沸点11℃,是一种黄绿色的气体,易溶于水。ClO2稳定性较差,“稳定性二氧化氯溶液”是以碳酸钠为稳定剂,有效成分为NaClO2。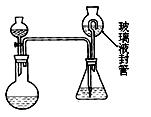
 某合作学习小组的同学拟证实其中的有效成分并测定二氧化氯的含量(用样品和酸反应产生二氧化氯的质量与样品质量的比值来衡量)。请回答下列问题:
某合作学习小组的同学拟证实其中的有效成分并测定二氧化氯的含量(用样品和酸反应产生二氧化氯的质量与样品质量的比值来衡量)。请回答下列问题: (1)为证实“稳定性二氧化氯溶液”中含有钠离子,其正确的操作步骤是:。
(1)为证实“稳定性二氧化氯溶液”中含有钠离子,其正确的操作步骤是:。 (2)为测定“稳定性二氧化氯溶液”中二氧化氯的含量,现进行以下操作:①取mg(2g左右)
(2)为测定“稳定性二氧化氯溶液”中二氧化氯的含量,现进行以下操作:①取mg(2g左右) 试样,置于烧瓶中,向分液漏斗中加入10mL盐酸溶液;②在锥形瓶中加入4g碘化钾,用100mL水溶解后,再加3mL硫酸溶液;③在玻璃液封管中加入水;④将分液漏斗中的盐酸溶液放入烧瓶中,关闭旋塞。缓慢加热烧瓶,使产生的二氧化氯气体全部通过导管在锥形瓶中被吸收;⑤将玻璃液封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用cmol/L硫代硫酸钠标准溶液滴定至蓝色消失(I2+2S2O32-=2I- +S4O62-),共用去VmL硫代硫酸钠溶液。
试样,置于烧瓶中,向分液漏斗中加入10mL盐酸溶液;②在锥形瓶中加入4g碘化钾,用100mL水溶解后,再加3mL硫酸溶液;③在玻璃液封管中加入水;④将分液漏斗中的盐酸溶液放入烧瓶中,关闭旋塞。缓慢加热烧瓶,使产生的二氧化氯气体全部通过导管在锥形瓶中被吸收;⑤将玻璃液封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用cmol/L硫代硫酸钠标准溶液滴定至蓝色消失(I2+2S2O32-=2I- +S4O62-),共用去VmL硫代硫酸钠溶液。
(Ⅰ)NaClO2与盐酸反应生成ClO2(还原产物为Cl-),该反应的化学 方程式为:
方程式为:
;ClO2通入锥形瓶与酸性碘化钾溶液反应, 二氧化氯被还原为氯离子,该反应的离子方程式为:。
二氧化氯被还原为氯离子,该反应的离子方程式为:。 (Ⅱ)装置中玻璃液封管的作用是:;如何确定烧瓶中
(Ⅱ)装置中玻璃液封管的作用是:;如何确定烧瓶中 的二氧化氯全部被锥形瓶中的液体吸收。
的二氧化氯全部被锥形瓶中的液体吸收。 (Ⅲ)“稳定性二氧化氯溶液”中,ClO2的质量分数为
(Ⅲ)“稳定性二氧化氯溶液”中,ClO2的质量分数为 (用m、c、V表示)。
(用m、c、V表示)。
实验室检验葡萄糖溶液常用如下方法:
(1)步骤①中所得的溶液称为▲。
(2)步骤③需加热,应选择的加热方式为上图中的▲(选填“A”、“B”)。
(3)下列关于该实验的说法正确的是▲
A.加热过程中应不断振荡试管,使其受热均匀
B.步骤①中的现象为先有白色沉淀,后沉淀恰好完全溶解
C.医学上曾用类似的反应来检验病人尿液中葡萄糖的含量是否偏高
下图中A—H为中学化学常用仪器,请根据要求回答: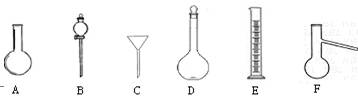
(1)上述仪器中,D的瓶体上标有(图中未画出)刻度线、温度、▲。
(2)分离乙醇和水的混合物,需用到上述仪器中的 ▲(填仪器的编号字母)。
(3)下列关于仪器B的使用方法中,正确的是▲。
A.使用前应先检查是否漏液
B.可用于分离乙醇和水的混合物
C.用于分液时应先打开分液漏斗上面的塞子
海藻中含有丰富的碘元素(以I-形式存在)。实验室中提取碘的流程如下:
(1)提出提取碘的过程中有关的实验操作名称:①③;
写出过程②中的有关反应的离子方程式。
(2)提取碘的过程中,可供选择的有机试剂是
| A.四氯化碳 | B.汽油 | C.酒精 | D.醋酸 |
某校化学课外小组设计了如右图所示的实验装置,进行钠跟水的反应实验,并收集、检验生成的气体。请回答下列问题:(1)关闭活栓A,打开右边的胶塞,先往U形管中加入约4/5体积的水,再加入约1/5体积的煤油,向煤油中加入一小块钠,立即塞好胶塞,反应开始前金属钠的位置在(填“a”、 “b”或“c”)处。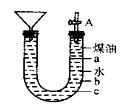
(2)反应后,钠在煤油层和水层界面之间上下跳动,反应平缓连续进行。试说明产生上述现象的原因:。