向200 mL ,某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的pH>7。
(1)此时溶液的溶质如果是单一成分,可能是____________________ ;如果是多种成分,可能是__________________________。
;如果是多种成分,可能是__________________________。
(2)在上述所得溶液中,逐滴缓慢滴加2 mol·L-1的盐酸,所得气体(不考虑溶解于水)的体积与所加盐酸的体积关系如图所示: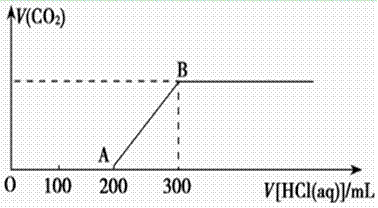
①加入盐酸200 mL之前,无气体产生,写出OA段发生反应的离子方程式_______________ ____________________________________________________。
____________________________________________________。
②B点时,反应所得溶液中溶质的物质的量浓度是__________ (溶液体积的变化忽略不计)。
近年,为提高能利用率,西方提出共生理念——为提高经济效益,人类生产活动尽可能多功能化.共生工程将会大大促进化学工业的发展.
(1)由于共生工程的应用,利用发电厂产生的SO2制成自发电池,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V.实际过程中,将SO2通入电池的极(填“正”或“负”),负极反应式为.用这种方法处理SO2废气的优点是.
(2)以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质.合成路线如下:
①生产中,向反应Ⅱ中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是.
②下列有关说法正确的是(填序号)。
| A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙 |
B.反应Ⅲ中发生反应的化学方程式为CaSO4+4C  CaS+4CO↑ CaS+4CO↑ |
| C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解 |
| D.反应Ⅴ中的副产物氯化铵可用作氮肥 |
③反应Ⅴ中选用了40%的乙二醇溶液做溶剂,温度控制在25℃,此时硫酸钾的产率超过90%,选用40%的乙二醇溶液做溶剂的原因是.
④(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统.写出二氧化氮与亚硫酸铵反应的化学方程式.
SiO2、SO2和CO2都是酸性氧化物,它们的化学性质有一定的相似性;Mg和Na的化学性质也有一定相似性。某兴趣小组用如图所示装置进行Mg与SO2反应的实验。
(1)选择制取SO2的合适试剂(填编号)。
①浓HCl②浓H2SO4
③Na2SO3固体④CaSO3固体
(2)上述装置还可优化,优化的方法是,实验后装置C中所得溶液离子浓度关系一定正确的是(选填字母)
| A.(Na+)= 2c(SO32-)+ c(HSO3-), |
| B.(Na+)> c(HSO3-)> c(SO32-)> c(H+)> c(OH-), |
| C.(H2SO3)+ c(H+)= c(SO32-)+ (OH-), |
| D.(Na+)+ c(H+)=" 2" c(SO32-)+ c(HSO3-)+ c(OH-) |
(3)甲同学推测Mg与SO2的反应与CO2相似,则该反应方程式为
乙同学的推测是:2Mg+3SO2 2MgSO3+S;
2MgSO3+S;
丙同学的推测是:3Mg+SO2 2MgO+MgS,
2MgO+MgS,
要验证甲、乙、丙三位同学的推测是否正确,丁同学作如下实验探究:
已知:MgSO3和MgS都是微溶于水,能与盐酸发生复分解反应放出气体;
限选试剂:2mol/L HCl、2mol/L HNO3、蒸馏水、2mol/LNaOH、品红溶液、澄清石灰水、2mol/LCuSO4;仪器和用品自选。请填写下表中的空格:
根据上述实验探究,能证明甲同学推测正确的操作和预期现象是_________________ _
(4)上述实验需要50mL,2mol/L的HCl,配制时应选用(10 mL ,25 mL ,,50 mL或100 mL)量筒量取36.5%,密度1.19g/mL的浓盐酸的体积。
2013年全国各地都遭遇“十面霾伏”。其中,机动车尾气和燃煤产生的烟气对空气质量恶化贡献较大。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0
若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是(填代号)。
(下图中υ正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
(2)机动车尾气和煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ/mol
2NO2(g) N2O4(g)△H=-56.9 kJ/mol
N2O4(g)△H=-56.9 kJ/mol
H2O(g) = H2O(l)ΔH = -44.0 kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:。
(3)用NH3催化还原NOX也可以消除氮氧化物的污染。如图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物转化率),
反应原理为:NO(g) +NO2(g)+2NH3(g) 2N2(g) + 3H2O(g)。
2N2(g) + 3H2O(g)。
①该反应的△S0,△H0(填“>”、“=”或 “<”)。
②对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),
则上述反应的KP=。
③以下说法正确的是。
A.第②种催化剂比第①种催化剂脱氮率高
B.相同条件下,改变压强对脱氮率没有影响
C.催化剂①、②分别适合于250℃和450℃左右脱氮
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理见图。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应为。
(5)硝酸工业尾气中氮氧化物(NO和NO2)可用尿素〔CO(NH2)2〕溶液除去。反应生成对大气无污染的气体。1 mol尿素能吸收工业尾气中氮氧化物(假设NO、NO2体积比为1:1)的质量为___________g。
元素及其化合物在生产、生活中具有广泛的用途。
Ⅰ.铬化学丰富多彩.
(1)在常温下,铬能缓慢与稀硫酸反应,生成蓝色溶液。 与铜相比,其金属活泼性(填“强”或“弱”);
⑵Cr( OH)3和Al( OH)3类似,也是两性氢氧化物,在水中存在酸式和碱式电离平衡,其酸式电离方程式是;
⑶工业上净化处理铬污染方法之一是:将含K2Cr2O7酸性废水放人电解槽内,加入适量的NaCl,以Fe和石墨为电极进行电解。经过一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去(已知KsP[ Fe(OH)3]=4.0×10-38,KsP[Cr(OH)3]=6.0×l0-31)。已知电解后的溶液中c( Fe3+)为2.0×10-13mol/L,则溶液中c(Cr3+)为mol/L。
Ⅱ.物质A~H有如图所示转化关系(部分生成物未列出)。A、E、F、G均为气体,D为金属单质。
请回答下列问题:
(1)A的电子式为D的化学式,C溶液的名称是。
(2)反应①的化学方程式为;
反应③的离子方程式为。
一种常用化学胶水的主要成分是聚乙烯醇,工业上以烃A为主要原料合成,其合成路线如下(某些反应条件略去):
已知:B的分子式为C2H4O,B的核磁共振氢谱中有两个峰,峰面积之比为3∶1;不饱和碳原子与羟基直接相连不稳定。请回答下列问题:
(1)A的结构简式为;
(2)聚乙烯醇中含有的官能团的结构简式为;
(3)反应Ⅱ的反应类型是;
(4)与CH3COOCH=CH2含有的官能团相同的同分异构体还有种;
(5)写出反应Ⅲ的化学方程式。