硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得。
已知:Na2S2O3在酸性溶液中不能稳定存在。
(1)某研究小组设计了制备Na2S2O3·5H2O装置和部分操作步骤如下。
I.打开K1,关闭K2,向圆底烧瓶中加入足量浓硫酸,加热。
II.C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。当C中溶液的pH接近7时即停止C中的反应,停止加热。
III.过滤C中的混合液。
IV.将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品。
①I中,圆底烧瓶中发生反应的化学方程式是 。
②II中,“当C中溶液的pH接近7时即停止C中的反应”的原因是 。
“停止C中的反应”的操作是 。
③III中,“过滤”用到的玻璃仪器是(填仪器名称) 。
④装置B中盛放的试剂是(填化学式) 溶液,其作用是 。
(2)依据反应2S2O32-+I2=S4O62-+2I-,可用I2的标准溶液测定产品的纯度。取5.5g产品,配制成100mL溶液。取10mL溶液,以淀粉溶液为指示剂,用浓度为0.050mol/L I2的标准溶液进行滴定,相关数据记录如下表所示。
| 编号 |
1 |
2 |
3 |
4 |
| 溶液的体积/mL |
10.00 |
10.00 |
10.00 |
10.00 |
| 消耗I2标准溶液的体积/mL |
19.99 |
19.98 |
17.13 |
20.03 |
② 断达到滴定终点的现象是 。
②Na2S2O3·5H2O在产品中的质量分数是(计算结果保留1位小数) 。
(共10分)如图装置中,已知A、B两池溶液的体积均为200mL:
(1)判断装置的名称:A池为;
(2)A池中左边石墨棒为极,
电极反应式为;
A池中总反应化学方程式为;
(3)若反应开始时,CuSO4溶液的浓度为1.0mol/L。工作一段时间后取出电极,测得导线上通过了0.04mole-。则反应后A池c(Cu2+)为mol/L(体积变化忽略不计)。
(共10分)以下框图中A~M是中学化学常见的物质,其中A、E是金属,F和J为气体单质,其余均为化合物或其溶液,C为淡黄色固体,D为红棕色粉末,M为红褐色固体。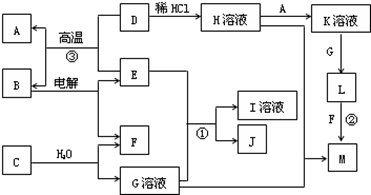
(1)B的化学式______;
(2)19.5gC与足量的水反应转移电子的物质的量为______mol;
(3)写出物质C的电子式;
(4)写出②、③反应的离子方程式②,③。
(共6分)一定温度下,在一定容积的密闭容器中发生如下可逆反应:
2A(g)+B(g) 2C(g) ,在反应过程中,C的物质的量n(C)随时间的变化关系如下图所示(从t1时间开始对反应体系升高温度)。试回答下列问题:
2C(g) ,在反应过程中,C的物质的量n(C)随时间的变化关系如下图所示(从t1时间开始对反应体系升高温度)。试回答下列问题: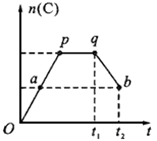
(1)a点时,反应的v(正)v(逆)(填“>”、“<”或“=”);
(2)此反应的逆反应为热反应(填“放”或“吸”);
(3)a、b两点的正反应速率:v(a)v(b)
(填“>”、“<”或“=”)。
(共4分)在一个固定体积为2升的密闭容器中,充入2molA和1molB, 发 生如下反应:2A(g)+B(g) 3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2mol/L。
3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2mol/L。
(1)2分钟内用B表示的平均反应速度为;
(2)若容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为:(填“吸热”或“放热”)反应。
铁与HNO3作用时,还原产物除与HNO3浓度有关外,还与温度有关。已知铁
与冷的稀HNO3反应时,主要还原产物为NO气体;与热的稀HN03反应时,主要还原产物
为N2O气体;当HNO3更稀时,其重要还原产物是NH4+。现有铁与稀 HNO3的作用,请分析
下图,回答有关问题。
假设曲线的各段内只有一种还原产物。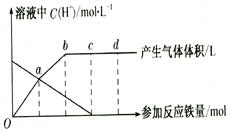
(1)0点到a点的还原产物是 ________ __。
(2)a点到b点的还原产物是____,其原因是 。
(3)试完成b点到c点的反应方程式:
口Fe+口HNO3——口Fe( NO3)3+口[ ]+口H20。
(4)反应过程中,到达 ________ 点时,HN03已完全反应。
(5)已知达到d点时反应结束,此时溶液中的主要阳离子是 。
(6)c点和d点参加反应的铁的物质的量之比是 ___________。