为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
【探究一】
(1)常温下,工业上用铁质容器盛放冷的浓硫酸,其原因是 ▲
(2)称取碳素钢6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认 为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选
为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选 用 ▲ (选填序号)。
用 ▲ (选填序号)。
a.KSCN溶液和氯水  b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取560mL(标准状况)气体Y通入足量溴水中,发生反应:
SO2+Br2+2H2O===2HBr+H2SO4,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g。由此推知气体Y中SO2的体积分数为 ▲ 。
【探究二】
根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1和Q2两种气体,其中Q1气体,在标准状况下,密度为0.0893g·L-1。为此设计了下列探究实验装置(图中夹持仪器省略,假设有关气体完全反应)。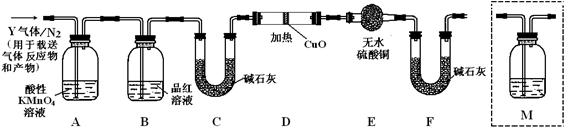
(3)装置B中试剂的作用是 ▲
(4)分析Y气体中的Q2气体是如何生成的 ▲ (用化学方程式表示)。
(5)为确认Q2的存在,需在装置中添加洗气瓶M于 ▲ (选填序号)。
a.A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有Q1,预计实验现象应是 ▲
(10分)实验室用乙醇与浓硫酸共热制取乙烯,常因温度过高生成少量SO2,有人设计了如下图所示实验,以验证上述混合气体中是否含有乙烯和SO2。
⑴.装置中X仪器的名称是:;碎瓷片的作用是:。
⑵.写出生成乙烯的反应方程式:。
⑶.A、B、C、D装置中可盛放的试剂是(从下列所给试剂中选出,填序号):
①品红溶液,②NaOH溶液,③溴水,④KMnO4酸性溶液。
A.;B.;C.;D.。
⑷.能说明SO2气体存在的现象是。
⑸.确证含有乙烯的现象是。
用已知浓度的盐酸滴定未知浓度的氢氧化钾溶液,滴定过程中进行如下操作,分别指出各项的操作对测定结果的影响(可用“偏高”、“偏低”、“无影响”).
(1)滴定前,滴定管尖咀处有气泡,滴定后气泡消失.
(2)滴定管经蒸馏水洗涤后,即装入标准溶液进行滴定
(3)滴定前,锥形瓶用蒸馏水洗涤后,未用待测的氢氧化钾溶液润洗就做滴定.
(4)用滴定管量取待测液后,又用蒸馏水洗涤滴定管,并将洗涤液一起注入锥形瓶中
实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:
MnO2+4HCl(浓)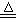 Cl2↑+MnCl2+2H2O
Cl2↑+MnCl2+2H2O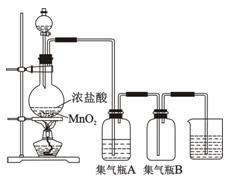
试回答下列问题:
(1)该反应是氧化还原反应吗?①(填“是”或“不是”),如果是氧化还原反应,指出②氧化剂是,③还原剂是,④写出该反应的离子 方程式。
方程式。
(2)集气瓶A中盛装的是饱和食盐水(注:氯气在饱和食盐水中溶解度很小,而氯
化氢在饱和食盐水中的溶解度则很大),其作用是。
(3)氯气溶于水显酸性,且氯气有毒,并有剧烈的刺激性,若吸入大量氯气,可中
毒死亡,所以氯气尾气直接排入大气中,会污染环境。实验室中可采用溶液来吸收有毒的氯气。
(4)一次实验中,加入浓盐酸200mL,其密度为1.19g·cm-3、HCl的质量分数为36.5%,
当MnO2刚好完全反应时,产生了5.6L(标准状况)的氯气。
试计算该浓盐酸的物质的量浓度和被氧化的HCl的物质的量。(请写出计算过程)
下图为实验室制取蒸馏水的装置示意图,根据图示回答下 列问题。
列问题。
(1)图中的两处明显的错误是:
①;
②。
(2)A仪器的名称是,B仪器的名称是。
(3)实验时A中除加入少量自来水
 外,为防止液体暴沸还需加入少量。
外,为防止液体暴沸还需加入少量。
海藻中提取碘的流程如图:
(1)指出提取碘的过程中有关实验操作③的名称:▲;
写出过程②中有关反应的离子方程式▲。
(2)在3mL碘水中,加入1mL四氯化碳,振荡、静置后,观察到试管里的分层现象是
▲。(注:下图试管中深色区为紫红色溶液)
(3)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出下图实验装置
中的错误之处。(加热装置烧杯下已垫石棉网)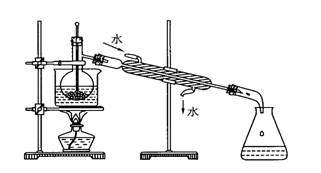
①▲;
②▲。