在一定温度下,向一个容积不变的密闭容器中加入 2 molA 和 2 molB ,发生反应:2A(g) + B(g) 3C( g) ΔH=-a kJ/mol(a>0),达到平衡时放出的热量为 bkJ,B的体积分数为ω1%。试回答:
3C( g) ΔH=-a kJ/mol(a>0),达到平衡时放出的热量为 bkJ,B的体积分数为ω1%。试回答:
(1)该反应平衡常数K表达式为________________________。 a与b的关系是a b(填“>”、“<”、“=”)。
(2)若升高温度,平衡常数K__________(填“增大”、“减小”或“不变”,下同),达到平衡时B的体积分数_________。
(3)下列说法中能表明该反应已达到平衡状态的是_________。
A.温度和体积一定 时,容器内压强不再变化 时,容器内压强不再变化 |
| B.温度和体积一定时,某一物质浓度不再变化 |
| C.条件一定,混合气体的平均相对分子质量不再变化 |
| D.温度和压强一定时,混合气体的密度不再变化 |
(4)若向上述平衡体系中再充入1 molB 和3 molC,在相同条件下达到平衡时B的体积分数为ω2 %,则ω1% ω2 % (填“>”、“ =”或“<”),理由是 。
新型锂离子电池在新能源的开发中占有重要地位,可用作节能环保电动汽车的动力电池。磷酸亚铁锂(LiFePO4)是新型锂离子电池的首选电极材料,它的制备方法如下:
方法一:将碳酸锂、乙酸亚铁[(CH3COO)2Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其他产物均以气体逸出。
方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀。沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂。
请回答下列问题:
(1)上述两种方法制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行。其原因是_________________。
(2)在方法二中,阳极生成磷酸亚铁锂的电极反应式为________________。
(3)已知该锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,则该电池放电时正极的电极反应式为 。
为建设美丽浙江,浙江省政府开展“五水共治”。
(1)城市饮用水处理时可用二氧化氯(ClO2)替代传统的净水剂Cl2。工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并标出电子转移的方向和数目:_______________。
(2)某地污水中的有机污染物主要成分是三氯乙烯 (C2HCl3),向此污水中加入KMnO4(高锰酸钾的还原产物为MnO2)溶液可将其中的三氯乙烯除去,氧化产物只有CO2,写出该反应的化学方程式_________________。
按下列要求填空:
(1)写出过氧化氢和过氧化钠的电子式: 、 。
(2)已知叠氮酸(HN3)是与醋酸酸性相近的酸。写出其在水溶液中电离的方程式: 。
(3)已知水溶液中,YO3n-和3S2-发生反应,离子方程式如下:YO3n-+3S2-+6H+=Y-+3S↓+3H2O,则微粒YO3n-所带的电荷为 。
(4)写出钢铁吸氧腐蚀中正极的电极反应式: 。
(5)在标准状况下,1L水中能溶解a L氯化氢气体,所得溶液密度为ρg/cm3 。请计算出氢化氢的物质的量浓度(要求化简) 。
盐酸多利卡因是一种局麻药及抗心律失常药,可由芳香烃A为起始原料合成:
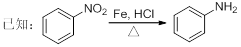
回答下列问题:
(1)B的官能团名称为____________,D的分子式为____________。
(2)反应①的化学方程式为_______________________,反应类型为____________,上述流程中,反应类型与①相同的还有____________(填反应序号)。
(3)反应④除了生成E外,另一种产物的化学式为____________。
(4)写出ClCH2COCl 与足量的NaOH溶液反应的化学方程式_______________________。
已知: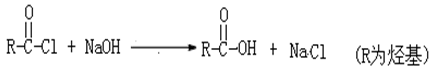
(5)C的芳香族同分异构体中,苯环上只有一个取代基的异构体共有________种(不考虑立体异构),其中核磁共振氢谱共有四个峰,且峰面积比为6:2:2:1的是______(写结构简式)。
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。
(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的外围电子排布式______,它位于周期表______区。
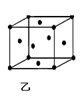
(2)富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途。富勒烯(C60)的结构如图甲,分子中碳原子轨道的杂化类型为_______;1 mol C60分子中σ键的数目为_____个。
(3)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓(GaAs)、硫化镉(CdS)薄膜电池等。
①第一电离能:As____Ga(填“>”、“<”或“=”)。
②SeO2分子的空间构型为________。
(4)三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,在太阳能电池制造中得到广泛应用。它可在铜的催化作用下由F2和过量的NH3反应得到,该反应的化学方程式为3F2+4 NH3 Cu NF3+3 NH4F,该反应中NH3的沸点 (填“>”、“<”或“=”)HF的沸点,NH4F固体属于 晶体。往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是____________ _______ 。图乙为一个金属铜的晶胞,此晶胞立方体的边长为a pm,Cu的相对原子质量为64,金属铜的密度为ρ g/cm3,则阿伏加德罗常数可表示为________ mol-1(用含a、ρ的代数式表示)。