在实验室中用锌、氧化铜、稀硫酸作原料,采取下列两条途径制取铜:
①Zn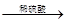 H2
H2 Cu
Cu
②CuO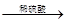 CuSO4
CuSO4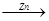 Cu
Cu
若用这两种方法制得铜的质量相等,则下列叙述符合实际实验结果的是
A.一定消耗相同质 量的氧化铜 量的氧化铜 |
B.一定消耗相同质量的锌 |
| C.一定消耗相同质量的稀硫酸 | D.一定生成相同质量的硫酸锌 |
在冷的浓HNO3中,下列金属易发生钝化作用的是()
| A.铜 | B.镁 | C.锌 | D.铝 |
生产、生活中离不开各类化学物质。下列化学物质中属于盐类的是()
| A.乙醇 | B.钻石 | C.胆矾 | D.生石灰 |
某溶液中含有两种溶质NaCl和H2SO4,物质的量之比为3∶1。用石墨作电极电解溶液,根据电极产物,可明显分为三个阶段。下列叙述不正确的是
| A.阴极只析出H2 | B.阳极先析出Cl2,后析出O2 |
| C.电解最后阶段为电解水 | D.溶液pH不断增大,最后为7 |
在原电池和电解池的电极上所发生的反应,同属氧化反应或同属还原反应的是:
| A.原电池的正极和电解池的阳极所发生的反应 |
| B.原电池的正极和电解池的阴极所发生的反应 |
| C.原电池的负极和电解池的阳极所发生的反应 |
| D.原电池的负极和电解池的阴极所发生的反应 |
用惰性电极电解下列溶液,电解一段时间后,阴极质量增加,电解液的PH下降的是:
| A.CuSO4 | B.AgNO3 | C.BaCl2 | D.H2SO4 |