把aL硫酸铵和硝酸铵的混合液分成两等份,一份加入bmol 烧碱并加热,刚好把NH3全部赶出。另一份需消耗cmolBaCl2,沉淀反应刚好完全,原溶液中硝酸根离子的物质的量浓度为
A.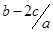 mol.l-1 mol.l-1 |
B.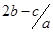 mol.l-1 mol.l-1 |
C.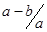 mol.l-1 mol.l-1 |
D.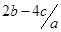 mol.l-1 mol.l-1 |
氮化铝广泛应用于电子陶瓷等工业领域。在一定条件下,AlN可通过反应:
Al2O3+N2+3C 2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是
| A.上述反应中,N2是还原剂,Al2O3是氧化剂 |
| B.AlN中氮的化合价为+3 |
| C.上述反应中,每生成1 mol AlN需转移3 mol电子 |
| D.AlN的摩尔质量为41 g |
下列离子方程式的书写正确的是
| A.实验室用大理石和稀盐酸制取CO2:2H+ + CO32- = CO2↑+ H2O |
| B.漂白粉溶液中通入SO2气体:Ca2+ + 2ClO- + SO2 =CaSO3↓+ 2HClO |
| C.金属钠加入水中:Na + 2H2O =Na++ 2OH- + H2↑ |
| D.NaHCO3溶液与NaOH溶液反应: OH- + HCO3-= CO32-+ H2O |
以下物质间的每步转化通过一步反应就能实现的是
| A.Al- Al2O3- Al(OH)3- NaAlO2 | B.Mg- MgCl2- Mg(OH)2- MgO |
| C.S- SO3- H2SO4- MgSO4 | D.Si- SiO2- H2SiO3 - Na2 SiO3 |
能与SO2气体发生反应且有沉淀产生的是
①NaOH溶液②H2S溶液 ③Ba(NO3)2酸性溶液 ④CaCl2和氨水的混合液
| A.② | B.②③ | C.②③④ | D.全部 |
某非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素说法正确的是:
| A.在自然界中只以化合态的形式存在 |
| B.单质常用作半导体材料和光导纤维 |
| C.最高价氧化物不与任何酸反应 |
| D.高温下与C反应生成该非金属单质和CO2 |