下图中A、B均为固体,其中B为单质。下图可用于工业生产F,F是衡量一个国家化工水平的标志。回答下列问题: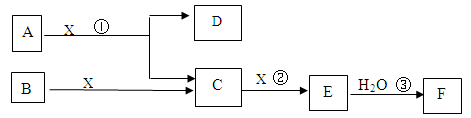
(1)A的化学式
(2)反应①是一个氧化还原反应,该反应发生时,每生成4 mol气体C,
转移电子 mol
(3)写出D与铝单质反应的化学方程式
(4)反应②是可逆反应,在2 L的密闭容器中投入 4 molC和3 molX,10分钟后反应达到平衡,平衡时混合气体共6 mol,则下列说法正确的是
4 molC和3 molX,10分钟后反应达到平衡,平衡时混合气体共6 mol,则下列说法正确的是
A.工业制取F时,C和X生成E的反应是在吸收塔进行
B.这10分钟内,X的平均速率是0.1mol/( L·min)
C.当C和X的消耗速率比为2:1时,标志着反应达到平衡
D.平衡时C的转化率是50%
E.在工业生产中可以通过增加X的量来 提高C的转化率
提高C的转化率
F.工业生产中直接用水来吸收E
(5)写出2.24L气体C与0.15mol氢氧化钠溶液反应的离子化学方程式
(6)将5 mL 0.02mol/L的F溶液与5 mL 0.02 mol/LNaOH溶液充分混合,若混合后溶液的体积为10mL,则混合液的pH是 写出F的一种用途
二氧化钛广泛应用于各类结构表面涂料、纸张涂层等,二氧化钛还可作为制备钛单质的原料。
Ⅰ.二氧化钛可由以下两种方法制备:
方法1:TiCl4水解生成TiO2·xH2O,过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2,此方法制备得到的是纳米二氧化钛。
(1)①TiCl4水解生成TiO2·xH2O的化学方程式为。
②检验TiO2·xH2O中Cl-是否被除净的方法是。
方法2:可用含有Fe2O3的钛铁矿(主要成分为FeTiO3,其中Ti元素化合价为+4价)制取,其主要流程如下: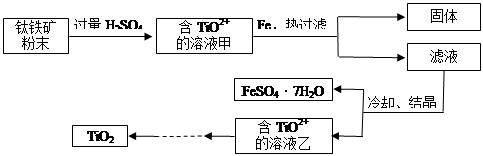
(2)Fe2O3与H2SO4反应的离子方程式是。
(3)甲溶液中除含TiO2+之外还含有的金属阳离子有。
(4)加Fe的作用是。
Ⅱ、二氧化钛可用于制取钛单质
(5)TiO2制取单质Ti,涉及到的步骤如下:
TiO2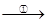 TiCl4
TiCl4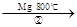 Ti
Ti
反应②的方程式是,该反应需要在Ar气氛中进
行,请解释原因:。
[化学—选修3:物质结构与性质]
有A、B、C、D、E、F、G、H原子序数递增的前四周期八种元素。请根据下列信息,回答问题:
| ①A、B、C、D、E、F为短周期主族元素,原子半径大小关系为A<D<C<B<F<E; |
| ②A与D形成的化合物常温下为液态; |
| ③B元素原子价电子(外围电子)排布为nSnnPn |
| ④F元素原子的核外p电子总数比s电子总数多1; |
| ⑤第一电子能:F<E; |
| ⑥G的基态原子核外有6个未成对电子; |
⑦H能形成红色(或砖红色)的 和黑色的HD两种化合物。 和黑色的HD两种化合物。 |
(1)G元素基态原子的价电子排布图为。
(2) 中B原子采取的杂化轨道类型为。
中B原子采取的杂化轨道类型为。
(3)根据等电子体原理,推测 分子的空间构型为。
分子的空间构型为。
(4)下列有关E、F的叙述正确的是()
a.离子半径E>F b.电负性E<F
c.单质的熔点E>F d. E、F的单质均能与氧化物发生置换
e. E的氧化物具有两性 f. E、F均能与氯元素构成离子晶体
(5) 极易溶于
极易溶于 ,原因是。
,原因是。
(6)E单质的晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,晶胞如下图丙所示。则E单质的晶体堆积模型为。
若已知E原子半径为r pm, 表示阿伏伽德罗常数,晶胞的边长为a。晶胞的高为h,则晶胞的密度可表示为g/cm3。(用只含r和
表示阿伏伽德罗常数,晶胞的边长为a。晶胞的高为h,则晶胞的密度可表示为g/cm3。(用只含r和 代数式表示)
代数式表示)
[化学—选修2:化学与技术]
硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到硫酸,如橡胶的硫化、表面活性剂“烷基苯硫酸钠”的合成,铅蓄电池的生产等。工业上生产硫酸的流程图如下:

请回答下列问题
(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,已知1g 完全燃烧放出7.2kJ的热量
完全燃烧放出7.2kJ的热量 燃烧反应的热化学方程式_______ ______。
燃烧反应的热化学方程式_______ ______。
(2)为了有利于SO2转化为SO3,且能充分利用热能,采用在具有多层催化剂且又热交换的________(填仪器名称)中进行反应。在如图Ⅰ所示的装置中, A处气体进入装置前需净化的原因是。
(3)精制炉气(含有 体积分数为7%、O2为11%、N2为82%)中
体积分数为7%、O2为11%、N2为82%)中 平衡 转化率与温度及压强关系如图2所示、在实际生产中,
平衡 转化率与温度及压强关系如图2所示、在实际生产中, 催化氧化反应的条件选择常压、
催化氧化反应的条件选择常压、 左右(对应图中A点):而没有选择
左右(对应图中A点):而没有选择 转化率更高的B或C点对应的反应条件,其原因分别是:、。
转化率更高的B或C点对应的反应条件,其原因分别是:、。
(4)已知:焙烧明矾的化学方程式4KAl(SO4)2•12H2O+3S═2K2SO4+2Al2O3+9SO2+48H2O。
焙烧711t明矾(M=474g/mol),若 的利用率为95%,可生产质量分数为98%的硫酸t。(结果保留小数点后一位)
的利用率为95%,可生产质量分数为98%的硫酸t。(结果保留小数点后一位)
(5)除硫酸工业外,还有许多工业生产。下列相关的工业生产流程中正确的是
| A.向装置中通入氮气且保持体积不变 |
| B.向装置中通入氧气且保持体积不变 |
| C.添加更多的催化剂 |
| D.降低温度,及时转移SO3 |
合成氨是人类研究的重要课题,目前工业合成氨的原理为:
合成氨是人类研究的重要课题,目前工业合成氨的原理为:
N2(g)+3H2(g) 2NH3(g)△H=-93.0kJ•mol-1,在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:
2NH3(g)△H=-93.0kJ•mol-1,在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:
相持恒温、恒容,测的反应达到平衡时关系数据如下:
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
3molH2、2molN2 |
6molH2、4molN2 |
2mol NH3 |
| 达到平衡的时间/min |
6 |
8 |
|
| 平衡时 N2的体积密度 |
C1 |
1.5 |
|
| 混合气体密度/g·L-1 |
 |
 |
|
| 平衡常数/ L2·mol-2 |
K甲 |
K乙 |
K丙 |
(1)下列各项能说明该反应已到达平衡状态的是(填写序号字母)
a.容器内H2、N2、NH3的浓度只比为1:3:2 b.容器内压强保持不变
c. d.混合气体的密度保持不变
d.混合气体的密度保持不变
e.混合气体的平均相对分子质量不变
(2)容器乙中反应从开始到达平衡的反应速度为 =
=
(3)在该温度下甲容器中反应的平衡常数K(用含C1的代数式表示)
(4)分析上表数据,下列关系正确的是(填序号):
a. b.氮气的转化率:
b.氮气的转化率: c.
c.  d.
d.
(5)另据报道,常温、常压下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成NH3和O2。已知:H2的燃烧热△H=-286KJ/mol,则由次原理制NH3反应的热化学方程式为
(6)希腊阿里斯多德大学的George Mamellos和Michacl Stoukides,发明了一种合成氨的新方法,在常压下,把氢气和用氨气稀释的氮气分别通入一个加热到 的电解池,利用能通过的氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,在电解法合成氨的过程中,应将N2不断地通入极,该电极反应式为。
的电解池,利用能通过的氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,在电解法合成氨的过程中,应将N2不断地通入极,该电极反应式为。
废旧碱性锌锰干电池内部的黑色物质A主要含有MnO2、NH4CI、ZnCI2,还有少量的FeCI2和炭粉,用A制备高纯MnCO3,的流程图如下。
(1)碱性锌锰干电池的负极材料是_________(填化学式)。
(2)第Ⅱ步操作的目的是________________________。
(3)第Ⅳ步操作是对滤液a进行深度除杂,除去Zn2+的离子方程式为____________________。
(已知:Ksp(MnS)=2.5×10-13,Ksp(ZnS)=1.6×10-24)
(4)为选择试剂X,在相同条件下,分别用5 g黑色物质M进行制备MnSO3的实验,得到数据如右表:
①试剂x的最佳选择是_________。
②第Ⅲ步中用选出的最佳试剂X与M的主要成分反应的化学方程式为_________。
(5)已知:MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀时pH为7.7。请补充完成以下操作:
第Ⅴ步系列操作可按一下流程进行:请补充完成操作:(第Ⅴ步系列操作中可供选用的试剂: 、乙醇)
、乙醇)
操作1:___________________;操作2:过滤,用少量水洗涤2~3次
操作3:检测滤液,表明SO42-已除干净; 操作4:___________________;
操作5:低温烘干。
(6)操作1可能发生反应的离子方程式