镍镉电池在通讯、交通及日常生活中有着广泛的应用,其工作原理可以表示为:Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)
2Ni(OH)2+Cd(OH) 2以下说法中正确的是:( )
2以下说法中正确的是:( )
| A.以上反应是可逆反应 |
| B.放电时,镉为正极 |
| C.充电时电池上标有“+”号的电极连接电源负极 |
| D.以镍镉电池为电源,电解Na2CO3溶液,当收集到气体的总体积为33.6L(标况下)时,电池中转移了2mol电子 |
NA代表阿伏加德罗常数。下列叙述正确的是()。
| A.标准状况下,22.4 L己烷中C—C共价键数目为5NA |
| B.0.1 mol·L-1 AlCl3溶液中含有氯离子数为0.3NA |
| C.1 mol Fe在1 mol Cl2中充分燃烧,转移电子数为3NA |
| D.20 g重水(12H2O)所含的电子数为10NA |
设NA为阿伏加德罗常数的数值,下列说法正确的是()。
| A.1 mol·L-1 NaCl溶液含有NA个Na+ |
B.1 mol Cu和足量稀硝酸反应产生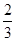 NA个NO分子 NA个NO分子 |
| C.1 L 0.1 mol·L-1氨水含有0.1NA个OH- |
| D.1 mol Fe2+与足量的H2O2溶液反应,转移2NA个电子 |
设NA为阿伏加德罗常数的数值,下列说法正确的是()。
| A.常温下,4 g CH4含有NA个C—H共价键 |
| B.1 mol Fe 与足量的稀HNO3反应,转移2NA个电子 |
| C.1 L 0.1 mol·L-1 NaHCO3溶液中含有0.1NA个HCO3- |
| D.常温常压下,22.4 L的NO2和CO2混合气体含有2NA个O原子 |
设NA为阿伏加德罗常数的数值,下列说法正确的是()。
| A.常温常压下,8 g O2含有4NA个电子 |
| B.1 L 0.1 mol·L-1的氨水中有0.1NA个NH4+ |
| C.标准状况下,22.4 L盐酸含有NA个HCl分子 |
| D.1 mol Na被完全氧化生成Na2O2,失去2NA个电子 |
关于下列各装置图的叙述中,不正确的是 ( )。
| A.装置①可验证HCl气体在水中的溶解性 |
| B.装置②可用于收集H2、NH3、Cl2、HCl、NO2、NO等 |
| C.装置③中X为四氯化碳,可用于吸收氨气或氯化氢 |
| D.装置④可用于干燥、收集氨气,并吸收多余的氨气 |