(9分)某同学对第四周期过渡元素产生浓厚的兴趣。想探究是否只有MnO2能催化KClO3受热分解?CuO、Fe2O3、Cr2O3等对氯酸钾的受热分解有没有催化作用?若有催化作用,效率怎样?请你与他一起进行实验探究:
I.课题名称:_________________________。
Ⅱ.实验仪器:略
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾
Ⅲ.实验步骤:略
Ⅳ.实验数据:
| 实验 编号 |
KClO3 (g) |
氧化物 |
产生气体(mL) (已折算为标况) |
耗时(s) |
||
| 化学式 |
质量(g) |
回收 |
||||
| 1 |
0.6 |
— |
— |
— |
10 |
480 |
| 2 |
0.6 |
MnO2 |
0.20 |
90% |
67.2 |
36.5 |
| 3 |
0.6 |
CuO |
0.20 |
90% |
67.2 |
79.5 |
| 4 |
0.6 |
Fe2 O3 O3 |
0.20 |
90% |
67.2 |
34.7 |
| 5 |
0.6 |
Cr2O3 |
0.20 |
异常 |
67.2 |
188.3 |
V.实验讨论:
⑴请用编号3的实验数据求得KClO3的分解率:为______%(保留一位小数)。
⑵在用Cr2O3做实验时,有刺激性气味的气体产生,同时绿色的混合物变成橘黄色(K2Cr2O7)。该刺激性气体可能是______(填化学式),用 检验。(填序号)
A、湿润的蓝色石蕊试纸 B、湿润的碘化钾淀粉试纸
C、湿润的PH试纸 D、湿润的红色石蕊试纸
Ⅵ.实验结论:________________________________________________________。
实验和探究对化学学科的发展起着非常重要的作用
(1)写出下列实验过程中所体现的总的离子反应方程式:
①用PH试纸测得醋酸钠溶液呈碱性:__________
②用石墨做电极,电解硝酸银溶液后,溶液呈酸性:__________
③根据浑浊出现的快慢,探究硫代硫酸钠与酸反应速率的影响因素:__________
(2)已知锌能溶解在NaOH溶液中,产生H2。某同学据此设计了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为S、质量为m1的镀锌铁皮与石墨用导线相连,放入6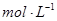 NaOH溶液中,判断锌层完全反应的标志是:__________,最后,取出铁片用水冲洗、烘干后称量,得质量为m2,设锌镀层单侧厚度为h,锌的密度为
NaOH溶液中,判断锌层完全反应的标志是:__________,最后,取出铁片用水冲洗、烘干后称量,得质量为m2,设锌镀层单侧厚度为h,锌的密度为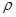 ,则h=__________
,则h=__________
(3)实验室测定绿矾中FeSO4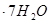 含量的步骤是:称1g绿矾,用30mL蒸馏水溶解并加入H2SO4溶液和H3PO4溶液,再用0.02mol/L KMnO4标准溶液滴定到溶液刚变成粉红色,停止滴定,消耗标准溶液VmL。反应中涉及的重要化学方程式有:
含量的步骤是:称1g绿矾,用30mL蒸馏水溶解并加入H2SO4溶液和H3PO4溶液,再用0.02mol/L KMnO4标准溶液滴定到溶液刚变成粉红色,停止滴定,消耗标准溶液VmL。反应中涉及的重要化学方程式有: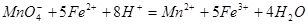
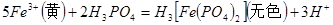
①绿矾的含量为__________%。
②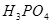 的作用是__________。
的作用是__________。
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用右图所示的装置制取乙酸乙酯。回答下列问题:
(1)写出制取乙酸乙酯的化学反应方程式。
(2)饱和碳酸钠溶液的主要作用是。
(3)浓硫酸的作用是与。
(4)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止。
(5)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。
1,2—二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂在实验室中可以用下图所示装置制备1,2—二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。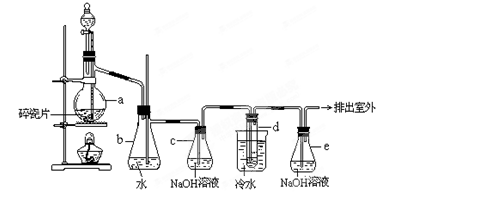
填写下列空白:
(1) 写出本题中制备1,2—二溴乙烷的两个化学反应方程式:
_________________________________;_________________________________
(2) 安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象______________________________。
(3) 容器c中NaOH溶液的作用是________________________________。
(4) 某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多。如果装置的气密性没有问题,试分析其可能的原因:
① ___________________________________________________________;
② ___________________________________________________________
实验室用固体烧碱配制500mL0.1000mol/L的NaOH溶液。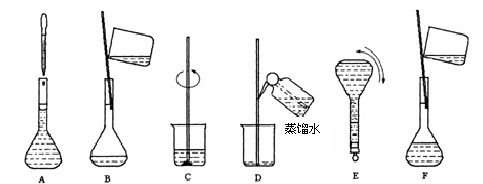
(1)需称量___________g烧碱,应放在_____________(填仪器名称)中称量
(2)配制过程中,不需要的仪器(填写代号)____________________
a、烧杯 b、量筒 c、玻璃棒 d、1000mL容量瓶 e、漏斗 f、胶头滴管
(3)根据实验需要和(2)所列仪器判断,完成实验还缺少的仪器是____________,___________,________。
(4)步骤B通常称为转移,步骤A通常称为
(5)将上述实验步骤A到F按实验过程先后次序排列
(6)在容量瓶中确定溶液体积的过程中,最后加入少量水的操作是______________________
有一种工业废水,已知其中含有大量的FeSO4,少量的Ag+和Na+,以及部分污泥。现设计了一个既经济又合理的方法以回收金属银、硫酸亚铁。以下列出实验步骤,试说明每一步骤的目的(不必写化学方程式)。
(1)过滤
(2)滤液中加入过量铁粉
(3)过滤
(4)将混有铁粉的Ag用稀硫酸处理,
(5)过滤
(6)将第(3)和(5)步的滤液合并,蒸发浓缩,冷却,
(7)过滤,