某化学兴趣小组在实验室制取漂白粉,并探究氯气与石灰乳反应的条件和产物。
已知:①二氧化锰与浓盐酸反应可制备氯气,同时生成MnCl2。
②氯气和碱的反应的过程中放出热量。温度较高时,氯气和碱还能发生如下反应:6Cl2 + 6Ca(OH)2 5CaCl2 + Ca(ClO3)2 + 6H2O
5CaCl2 + Ca(ClO3)2 + 6H2O
该兴趣小组设计了下列实验装置,进行实验。
甲 乙 丙 丁
请回答下列问题:
(1)①甲装置中发生反应的化学方程式是 。
②乙装置中的试剂是 ,作用是 。
③该兴趣小组用300mL 12mol/L盐酸与17.4g MnO2制备氯气,并将所得氯气与过量的石灰乳反应。则理论上最多可制得标况下氯气 L,Ca(ClO)2 g。
(2)小组成员发现,产物中Ca(ClO)2的质量明显小于理论值。他们讨论后认为,部分氯气未与石灰乳反应而逸出,以及温度升高是可能原因。为了探究反应条件对产物的影响,他们另取一定量的石灰乳,缓慢、匀速地通入足量氯气,得出了ClO—、ClO3— 两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为下图(不考虑氯气和水的反应)。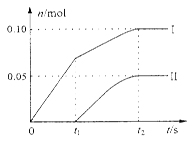
①图中曲线Ⅱ表示 离子的物质的量随反应时间变化的关系。
②所取石灰乳中含有Ca(OH)2的物质的量为 mol。
③另取一份与②等物质的量Ca(OH)2的石灰乳,以较大的速率通入足量氯气,反应后测得产物中Cl—的物质的量为0.35mol,则产物中 = 。
= 。
高纯氧化铝可用于制高压钠灯的陶瓷管。实验室制取高纯氧化铝的流程如下:
(1)“除杂”操作是加入适量过氧化氢,用氨水调节溶液的pH约为8.0,以除去硫酸铵溶液中的少量Fe2+。检验Fe2+已除尽的实验操作是。
(2)通常条件下,KSP[Fe(OH)3]=4.0×10-38,除杂后溶液中c(Fe3+)=。
(3)配制硫酸铝溶液时,需用硫酸酸化,酸化的是目的是。
(4)“结晶”操作中,母液经蒸发浓缩至溶液表面刚出现薄层的结晶为止,冷却结晶,得到铵明矾(含结晶水)。母液不能蒸干的原因是。
(5)“分离”操作名称是(填字母代号)
a.蒸馏b.分液c.过滤
(6)测定铵明矾组成的方法是:
a.称取0.906g铵明矾样品,高温灼烧,得Al2O3残留固体0.102g;
b.称取0.906g铵明矾样品,用适量蒸馏水溶解,再加入稍过量的BaCl2溶液,经静置、过滤、洗净,得BaSO40.932g;
c.称取0.906g样品,加入足量的NaOH溶液,加热,产生气体依次通过碱石灰和浓硫酸,浓硫酸增重0.0340g。
则铵明矾的化学式为 。
(7)有同学认为,第(6)问测定铵明矾组成的方法a、b、c三个试验中,有一个实验不必实施也能推导出铵明矾的化学式,您认为合理吗?若合理,请在下列空格写出不必实施的实验代号(即填上a、b、c其中的一个);若不合理,则在下列空格填上“不合理”,你的结论是。
漂白液、漂白粉和漂粉精既可作棉、麻、纸张的漂白剂,又可用作游泳池及环境的消毒剂。它们在生产、生活中有广泛应用。某实验小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液,其中有效成分为NaClO)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件。该小组同学为探究中毒原因进行了如下实验。
(1)小组成员甲同学依据漂白液具有漂白消毒的性质推测,漂白液中ClO-具有氧化性。进行如下实验:
Ⅰ.取10 mL漂白液,依次加入Na2SO3溶液和BaCl2溶液,观察到有白色沉淀生成,经检验白色沉淀不溶于盐酸。
Ⅱ.另取10 mL漂白液,加入品红溶液,发现溶液红色逐渐变浅,一段时间后褪为无色。
Ⅲ.再取10 mL漂白液,加入品红溶液,加入少量稀硫酸酸化后,观察溶液红色立即变为无色。
①由实验Ⅰ得出ClO-具有氧化性,写出相关反应的离子方程式__________________。
②对比实验Ⅱ和Ⅲ说明ClO-氧化性与溶液酸碱性的关系是____________________。
(2)小组成员乙同学依据(1)中的实验提出:漂白液在酸性溶液中有Cl2生成,为此进行如下实验:
首先,他利用pH计分别测得漂白液pH>7,饱和KAl(SO4)2溶液pH<7。然后用下图所示的装置继续实验,探究漂白液在酸性溶液中是否能反应生成Cl2。
①在测定漂白液pH的实验中,乙同学没有选择pH试纸的理由可能是__________;
②若打开分液漏斗活塞向烧瓶中加入硫酸,不久烧瓶中有黄绿色气体产生。A中反应的离子方程式__________________。
③若打开分液漏斗活塞向烧瓶中加入饱和KAl(SO4)2溶液,预计只有观察到以下现象__________,才能说明漂白液与酸性溶液混合会产生Cl2。
(3)为了进一步了解漂白液生产和保存的实际意义,小组其他成员还研究漂白液的稳定性,他们查阅资料,下图是30℃时,pH=11的漂白液中NaClO的质量百分含量随时间变化图:
①分析分解速率v(Ⅰ)与v(Ⅱ)的大小关系,原因是
②4d~ 8d,Ⅰ中v(NaClO)=mol/(L·d)(常温下漂白液的密度约为1g / cm3,且溶液体积变化忽略不计,结果保留2位有效数字。)
资源的开发利用和保护环境关系到人类可持续发展,需要全社会的共同努力。信息时代产生的大量电子垃圾对环境构成了极大的威胁。某课题小组根据废旧显示屏玻璃中含SiO2、Fe2O3、CeO2、FeO等物质,他们设计如下流程,以此玻璃粉末为原料,制得Ce(OH)4和硫酸铁铵矾[Fe2(SO4) 3·(NH4) 2SO4·24H2O]。
已知:Ⅰ.酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式,Ce4+有较强氧化性;
Ⅱ.CeO2不溶于稀硫酸,也不溶于NaOH溶液。
回答以下问题:
(1)反应①加NaOH溶液,玻璃粉末中的(写化学式)转化为可溶性物质。
(2)反应②中H2O2的作用是。
(3)反应③的离子方程式是。
(4)已知有机物HT能将Ce3+从水溶液中萃取出来,该过程可表示为:
2Ce3+(水层)+ 6HT(有机层) 2CeT3 (有机层)+ 6H+(水层)
2CeT3 (有机层)+ 6H+(水层)
从平衡角度解释:向CeT3 (有机层)加入H2SO4 获得较纯的含Ce3+的水溶液的原因是。在实验室中进行萃取分液操作必需的仪器有铁架台(含铁圈)、_______________,振荡,静置,当液体分层后,接下来的操作是_____________________。
(5)相同物质的量浓度的以下四种溶液中,NH4+的浓度由大到小的顺序是(填字母)。
| A.Fe2(SO4) 3·(NH4) 2SO4·24H2O | B.(NH4) 2CO3 |
| C.(NH4)2SO4 | D.NH4HSO4 |
某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
可选药品:浓硝酸、3 mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳。已知:氢氧化钠溶液不与NO反应,能与NO2反应。
2NO2+2NaOH====NaNO3+NaNO2+H2O
(1)实验应避免有害气体排放到空气中。装置③④⑥中盛放的药品依次是:
、、。
(2)装置①中发生反应的化学方程式是。
(3)装置②的作用是,发生反应的化学方程式是。
(4)若①中消耗铜片12.8g,产生的氮氧化物与O2完全反应转化为硝酸,试计算消耗标准状况下O2的体积为L。
(5)该小组得出的结论所依据的实验现象是。
(6)实验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个实验来判断两种看法是否正确。这些方案中可行的是(选填序号字母)。
| A.加热该绿色溶液,观察颜色变化 |
| B.加水稀释该绿色溶液,观察绿色变化 |
| C.向该绿色溶液中通入氮气,观察颜色变化 |
| D.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化 |
实验室制取SO2的反应原理为:Na2SO3+H2SO4(浓)==Na2SO4+SO2↑+H2O。
请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:
转化率=
二氧化硫熔点(℃):-72.7,沸点(℃):-10
三氧化硫熔点(℃):16.8,沸点(℃):44.8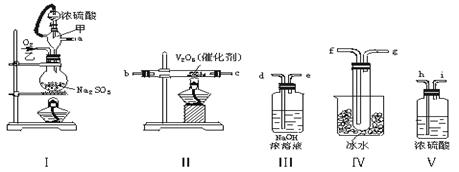
(1)这些装置的连接顺序(按气体左右的方向)是
→→→→→→→(填各接口的编号)。
(2)实验时甲仪器的作用是。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是。
(4)Ⅳ处观察到的现象是。
(5)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重mg,则本实验中SO2的转化率为。