资源的开发利用和保护环境关系到人类可持续发展,需要全社会的共同努力。信息时代产生的大量电子垃圾对环境构成了极大的威胁。某课题小组根据废旧显示屏玻璃中含SiO2、Fe2O3、CeO2、FeO等物质,他们设计如下流程,以此玻璃粉末为原料,制得Ce(OH)4和硫酸铁铵矾[Fe2(SO4) 3·(NH4) 2SO4·24H2O]。
已知:Ⅰ.酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式,Ce4+有较强氧化性;
Ⅱ.CeO2不溶于稀硫酸,也不溶于NaOH溶液。
回答以下问题:
(1)反应①加NaOH溶液,玻璃粉末中的 (写化学式)转化为可溶性物质。
(2)反应②中H2O2的作用是 。
(3)反应③的离子方程式是 。
(4)已知有机物HT能将Ce3+从水溶液中萃取出来,该过程可表示为:
2Ce3+(水层)+ 6HT(有机层) 2CeT3 (有机层)+ 6H+(水层)
2CeT3 (有机层)+ 6H+(水层)
从平衡角度解释:向CeT3 (有机层)加入H2SO4 获得较纯的含Ce3+的水溶液的原因是 。在实验室中进行萃取分液操作必需的仪器有铁架台(含铁圈)、_______________,振荡,静置,当液体分层后,接下来的操作是_____________________。
(5)相同物质的量浓度的以下四种溶液中,NH4+的浓度由大到小的顺序是 (填字母)。
| A.Fe2(SO4) 3·(NH4) 2SO4·24H2O | B.(NH4) 2CO3 |
| C.(NH4)2SO4 | D.NH4HSO4 |
(10)按要求完成硝酸钾晶体的制备实验:
| 步骤 |
操作 |
具体操作步骤 |
现象解释结论等 |
① |
溶解 |
取20克NaNO3和17克KCl溶解在35ml水中,加热至沸,并不断搅拌。 |
固体溶解 |
| ② |
蒸发 |
继续加热搅拌,使溶液蒸发浓缩。 |
有a晶体析出。 |
| ③ |
热过滤 |
当溶液体积减少到约原来的一半时,迅速趁热过滤 |
滤液中的最主要成分为b。 |
| ④ |
冷却 |
将滤液冷却至室温。 |
有晶体析出。 |
 ⑤ ⑤ |
按有关要求进行操作 |
得到初产品硝酸钾晶体 |
|
| ⑥ |
将得到的初产品硝酸钾晶体溶于适量的水中,加热、搅拌,待全部溶解后停止加热,使溶液冷却至室温后抽滤。 |
得到纯度较高的硝酸钾晶体 |
|
| ⑦ |
检验 |
分别取⑤、⑥得到的产品,配置成溶液后分别加入1滴1mol/l的HNO3和2滴0.1mol/l的AgNO3 |
可观察到⑤、⑥产品中出现的现象分别是⑤产品中产生白色沉淀,⑥产品中无明显现象。 |
(1)把上述各步骤中的内容补充完整:a: b:
(2)写出步骤③趁热过滤的目的,步骤⑥的操作名称,步骤⑦中产生白色沉淀的离子方程式
(3)步骤⑥的抽滤装置如图所示,仪器A的名称,该装置中的错误之处是;抽滤完毕或中途需停抽滤时,应先,然后。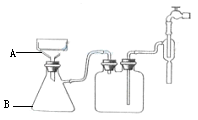
某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实现象如下表:
| 实验方案 |
实验现象 |
| ①用砂纸擦后的镁带与沸水反应,再向反应后溶液中滴加酚酞 |
(A)浮于水面,熔成一个小球,在水面上无定向移动,随之消失,溶液变红色 |
| ②向新制的H2S饱和溶液中滴加新制的氯水 |
(B)产生气体,可在空气中燃烧,溶液变成浅红色 |
| ③钠与滴有酚酞试液的冷水反应 |
(C)反应不十分强烈,产生无色气体 |
| ④镁带与2 mol•L-1的盐酸反应 |
(D)剧烈反应,产生无色气体 |
| ⑤铝条与2 mol•L-1的盐酸反应 |
(E)生成白色胶状沉淀,既而沉淀消失 |
| ⑥向AlCl3溶液中滴加NaOH溶液至过量 |
(F)生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告:
(1)实验目的: 。
(2)实验用品:
仪器:试管、酒精灯、砂纸、镊子、小刀、胶头滴管、滤纸
药品:镁带、钠、铝条、新制氯水、新制饱和硫化氢溶液、2 mol•L-1的盐酸、NaOH溶液、蒸馏水、酚酞、AlCl3溶液
(3)实验内容:(填写题给信息表中的序号)
| 实验方案 |
实验现象(填写序号) |
| ① |
|
| ② |
|
| ③ |
|
| ④ |
|
| ⑤ |
|
| ⑥ |
(4)实验结论: 。
(5)请你补充简单易行的实验方案,证明此周期中另外两种元素的性质递变规律。
某化学研究小组将锌片和铜片插入某种电解质溶液,锌片和铜片用导线相连,形成原电池装置。
(1)若电解质溶液是稀硫酸,则发生氧化反应的是 极(填“锌”或“铜”,下同),溶液中的H+ 移向 极,铜极上的电极反应式是 。
(2)若电解质溶液是硫酸铜溶液,铜极上的电极反应式是 ,若反应过程中有0.2mol电子发生转移,则电解质溶液质量增加 g。
[化学——选修化学与技术]
硫酸是工业生产中最为重要的产品之一。
(1)工业上制硫酸主要分为_________、________、_________三个阶段。
(2)下列是第二阶段反应的有关实验数据,请选择最合适的生产条件____________。
(3)现在欲提高反应速率和SO2的转化率,下列措施可行的是()
| A.向装置中通入氮气且保持体积不变 |
| B.向装置中通入氧气且保持体积不变 |
| C.添加更多的催化剂 |
| D.降低温度,及时转移SO3 |
(4)硫酸生产的尾气中含有少量SO2,可有石灰水吸收后,再用硫酸处理。此过程涉及的化学反应方程式为__________________,______________。
(5)若进入第二阶段所用设备中气体的体积分数为:SO27%、O211%、N282%。现有100体积这样的混合气体在反应后变成96.7体积,则反应后混合气体中N2和SO3的体积比为___________,此时SO2转化率为__________。
某同学受2Mg+CO2  2MgO+C的启发,用如图所示的装置进行Mg和SO2的实验。
2MgO+C的启发,用如图所示的装置进行Mg和SO2的实验。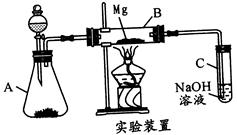
(1)选择制取SO2的合适试剂:_____________。
①10%的H2SO4溶液②80%的H2SO4溶液③Na2SO3固体④CaSO3固体
(2)写出装置B中发生的主要反应的化学方程式:____________
(3)有同学认为本实验应在镁下方垫一不锈钢片,理由是______________
(4)你认为该装置是否有不足之处?__________如果有,请列出两点:_________、________。
(5)对于反应后试管C中的成份某同学提出如下假设:
假设①全部是NaSO3假设②全部是NaHSO3
假设③_____________________假设④_____________________
请补充完善假设。并将下表实验检验设计及结论补充完整。
| 实验操作 |
预期现象 |
结论 |
| (1)取少许反应后试管C中的溶液加入足量的BaCl2溶液 |
无白色沉淀产生 |
证明假设_______是正确的 |
| (2)若有白色沉淀产生再检测(1)的上层溶液的PH |
若PH>7 |
证明__________正确 |
| 若PH=7 若PH<7 |
证明__________正确 证明__________正确 |