某同学受2Mg+CO2  2MgO+C的启发,用如图所示的装置进行Mg和SO2的实验。
2MgO+C的启发,用如图所示的装置进行Mg和SO2的实验。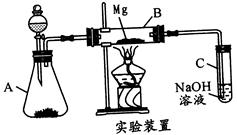
(1)选择制取SO2的合适试剂:_____________。
①10%的H2SO4溶液 ②80%的H2SO4溶液 ③Na2SO3固体 ④CaSO3固体
(2)写出装置B中发生的主要反应的化学方程式:____________
(3)有同学认为本实验应在镁下方垫一不锈钢片,理由是______________
(4)你认为该装置是否有不足之处?__________如果有,请列出两点:_________、________。
(5)对于反应后试管C中的成份某同学提出如下假设:
假设①全部是NaSO3 假设②全部是NaHSO3
假设③_____________________ 假设④_____________________
请补充完善假设。并将下表实验检验设计及结论补充完整。
| 实验操作 |
预期现象 |
结论 |
| (1)取少许反应后试管C中的溶液加入足量的BaCl2溶液 |
无白色沉淀产生 |
证明假设_______是正确的 |
| (2)若有白色沉淀产生再检测(1)的上层溶液的PH |
若PH>7 |
证明__________正确 |
| 若PH=7 若PH<7 |
证明__________正确 证明__________正确 |
某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表。
| 实验方案 |
实验现象 |
| ①用砂纸擦后的镁带与沸水反应,再向反应后溶液中滴加酚酞 |
(A)浮于水面,熔成一个小球,在水面上无定向移动,随之消失,溶液变红色 |
| ②向新制的H2S饱和溶液中滴加新制的氯水 |
(B)产生气体,可在空气中燃烧,溶液变成浅红色 |
| ③钠与滴有酚酞试液的冷水反应 |
(C)反应不十分强烈,产生的气体可以在空气中燃烧 |
| ④镁带与2 mol·L-1的盐酸反应 |
(D)剧烈反应,产生可燃性气体 |
| ⑤铝条与2 mol·L-1的盐酸反应 |
(E)生成白色胶状沉淀,既而沉淀消失 |
| ⑥向AlCl3溶液滴加NaOH溶液至过量 |
(F)生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告
(1)实验目的:探究同周期元素的金属性和非金属性的递变规律。
(2)实验用品:仪器:①②③④ 试管夹 ⑤ 镊子 ⑥ 小刀 ⑦ 玻璃片⑧ 砂纸⑨ 烧杯等;
药品:钠、镁带、铝条、2 mol·L-1的盐酸、新制的氯水、饱和的H2S溶液、AlCl3溶液、NaOH溶液等。
(3)实验内容:(填写与实验方案相对应的实验现象)
①②③④⑤⑥(用A-F表示)
写出③的离子方程式。
(4)实验结论:。
可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)请填空: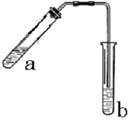
(1)试管a中需要加入浓硫酸、冰醋酸和乙醇各2mL,正确的计入顺序操作是
(2)为防止a中的液体在实验时发生暴沸,在加热前应采取的措施是
(3)实验中加热试管a的目的是:
① ②
(4)试管b中加有饱和Na2CO3溶液 ,其作用是
(5)反应结束后,振荡试管b静置,观察到的现象是
为了证明在实验室制备得到的Cl2中会混有HCl,甲同学设计了如下图所示的实验装置,按要求回答下列问题。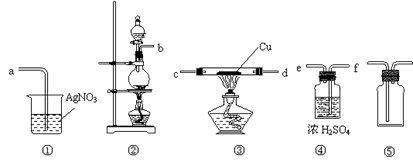
(1)请根据甲同学的示意图,实验装置从左至右的连接顺序为:
装置②→ → → ;
(2)装置②中主要玻璃仪器的名称___________、___________、___________;
(3)实验室制备Cl2的离子方程式为________________________________;
(4)装置③中Cu的作用 (用化学方程式表示);
(5)乙同学认为甲同学实验设计仍然存在缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为此,乙同学提出气体通入装置①之前,要加装一个检验装置 ,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置
,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置 应放入 。
应放入 。
(6)实验结束,处理多余Cl2的常用试剂是______________,有关反应的离子方程式为______________________________________________。
(7)实验用的AgNO3需配制,下列情况会使所配溶液浓度偏高的是(填序号) ____。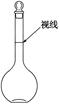
a.某同学观察液面的情况如图所示
b.没进对烧杯、玻璃棒进行洗涤操作
c.定容时,不慎超过了刻度线
d.AgNO3固体称量时,砝码上沾有杂质
e.容量瓶使用前内壁沾有水珠
(一)括号中的物质是杂质,写出除去这些杂质的试剂:
(1)MgO (Al2O3) (2)Cl2(HCl)
(3)FeCl3(FeCl2) (4)NaHCO3溶液(Na2CO3)
(二)(6分)海水中含有大量的氯化镁,从海水中提取镁的生产流程如下图所示: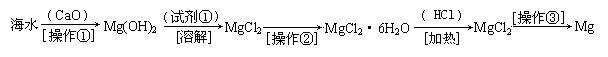
回答下列问题:
写出在海水中加入氧化钙生成氢氧化镁的化学方程式 ;
操作①主要是指 ;试剂①可选用 ;
操作②是指 ;经操作③最终可得金属镁。
(三)实验室配制480ml 0.1mol·L-1的Na2CO3溶液,回答下列问题:
(1)应用托盘天平称取十水碳酸钠晶体g。
(2)如图所示的仪器配制溶液肯定不需要的是 (填序号),本实验所需玻璃仪器E规格为 mL。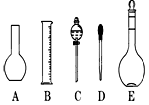
(3)容量瓶上标有:①温度、②浓度、③容量、④压强、⑤刻度线、⑥酸式或碱式这六项中的。(填数字符号)
(4)配制所需的主要仪器是:a容量瓶、b烧杯、c胶头滴管、d托盘天平,它们在操作过程中使用的前后顺序是。(填写字母,每种仪器只能选择一次)
(5)玻璃棒是化学实验中常用的一种玻璃工具,则在配制溶液的过程中玻璃棒共起到了
种用途。(填写数字)
(6)若实验时遇到下列情况,将使溶液的浓度偏低的是。
| A.配制前没有将容量瓶中的水除尽; | B.碳酸钠失去了部分结晶水; |
| C.碳酸钠晶体不纯,其中混有氯化钠; | D.称量碳酸钠晶体时所用砝码生锈; |
E. 定容时仰视刻度线
某化学课外小组用右图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。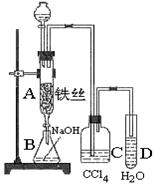
(1)写出A中反应的化学方程式:
(2)A中的现象是。
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是,写出有关的化学方程式 。
(4)C中盛放CCl4的作用是。
(5)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入,现象是