(10)按要求完成硝酸钾晶体的制备实验:
| 步骤 |
操作 |
具体操作步骤 |
现象解释结论等 |
| ① |
溶解 |
取20克NaNO3和17克KCl溶解在35ml水中,加热至沸,并不断搅拌。 |
固体溶解 |
| ② |
蒸发 |
继续加热搅拌,使溶液蒸发浓缩。 |
有 a 晶体析出。 |
| ③ |
热过滤 |
当溶液体积减少到约原来的一半时,迅速趁热过滤 |
滤液中的最主要成分为 b 。 |
| ④ |
冷却 |
将滤液冷却至室温。 |
有晶体析出。 |
 ⑤ ⑤ |
|
按有关要求进行操作 |
得到初产品硝酸钾晶体 |
| ⑥ |
|
将得到的初产品硝酸钾晶体溶于适量的水中,加热、搅拌,待全部溶解后停止加热,使溶液冷却至室温后抽滤。 |
得到纯度较高的硝酸钾晶体 |
| ⑦ |
检验 |
分别取⑤、⑥得到的产品,配置成溶液后分别加入1滴1mol/l的HNO3和2滴0.1mol/l的AgNO3 |
可观察到⑤、⑥产品中出现的现象分别是⑤产品中产生白色沉淀,⑥产品中无明显现象。 |
(1)把上述各步骤中的内容补充完整:a: b:
(2)写出步骤③趁热过滤的目的 ,步骤⑥的操作名称 ,步骤⑦中产生白色沉淀的离子方程式
(3)步骤⑥的抽滤装置如图所示,仪器A的名称 ,该装置中的错误之处是 ;抽滤完毕或中途需停抽滤时,应先 ,然后 。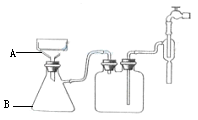
已知NaHCO3低温时溶解度小。德榜制碱的方法是:向氨化的饱和食盐水中通入过量的二氧化碳,即有晶体析出,经过滤、洗涤、焙烧得纯碱。此过程可以表示为:
①NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl(此反应是放热反应)
②2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
现某化学小组根据上述原理在实验室中模拟制碱过程,下图C装置是溶有氨和NaCl的溶液,且二者均达到了饱和。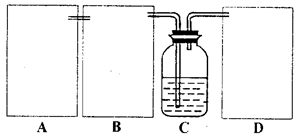
(1)制CO2时为了使反应随开随用,随关随停,上图A方框内应选用以下_________装置(填序号)。简述该装置能随关随停的理由________________。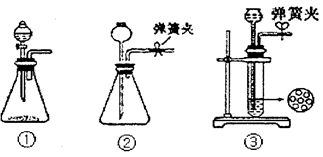
(2)为使实验能够进行,在B、D方框内补上所需装置:_________________(将装置图画在答题卡上),并指明所用试剂:_________________。
(3)该小组同学按正确的方法连接装置,检验气密性合格后进行实验,发现析出的晶体非常少。老师的指导下,他们对某个装置进行了改进,达到了实验目的。你认为他们的改进方法是___________________。
(4)若所用饱和食盐水中含有NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.46g,假设第二步分解时没有损失,则Na2CO3的产率为______________。
下图为某套实验装置示意图,无法看到实验说明,加热装置已经省略。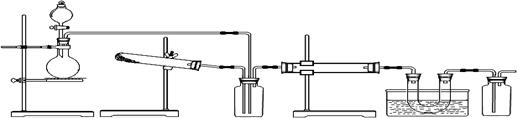
A B C D E F
甲同学认为此套装置用于合成物质X, D处盛放V2O5,E处冰水冷却的U型管中有固体X出现。
(1)事实上此装置所附实验说明符合甲同学的推断,那么X的化学式是,C装置中盛放的液体药品是。
(2)甲同学方案中为了提高A装置产物的转化率,可以增大B装置产物的通入量。要知道A、B两个装置产物的通入量哪个大,可通过观察得知。
(3)若F装置中盛放的药品是。本实验有无不妥之处?如有请答出改进方案;若无,此问可不答_。
乙同学认为此套装置用于合成物质Y,D处盛放铂铑合金网,E处冰水冷却的U型管中有红棕色气体Y生成且越接近U型管底部颜色越浅。对于A处,乙认为没有加热装置。
(4)若要用上述装置完成乙同学所认为的实验,C处所起作用与合成X时最初所起作用一致,那么C处的广口瓶应改为,所装药品为。
(5)写出乙同学认为的D装置中发生反应的化学方程式。
(6)为什么此时U型管中的红棕色气体越接近管底颜色越浅?
某过碳酸钠中含有少量过氧化钠,甲.乙两位同学各称取一定质量的该样品,并用如下图所示仪器测定样品的纯度。仪器的连接顺序,甲同学:⑤—⑧—③—⑦—④;乙同学:⑤—③—②。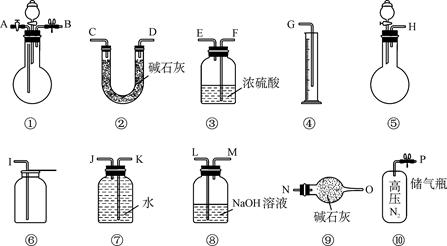
已知:过碳酸钠(Na2CO4).过氧化钠分别跟足量稀硫酸反应的化学方程式如下:
2Na2CO4+2H2SO4===2Na2SO4+2CO2↑+O2↑+2H2O;
2Na2O2+2H2SO4===2Na2SO4+O2↑+2H2O。
(1)甲同学想通过实验测得的数据是____________,他选用的装置________(填序号)是没有必要的。实验中甲同学测得气体体积为V L (20 ℃,1大气压),计算时他未将V L换算到标准状况,则他得到的Na2CO4的质量分数________(填“偏高”或“偏低”')。
(2)乙同学想通过实验测得的数据是________________。按他测得的数据计算出的实验结果有可能偏高,原因是________________;也有可能偏低,原因是 。
(3)为了测得准确的实验数据,请你将乙同学的实验设计进行改进,写出你所选用仪器的连接顺序(每种仪器最多使用一次,也可以不用):________________(填序号)。
(1)如图所示装置,为实现下列实验目的,其中y端适合于作入口的是_____多项)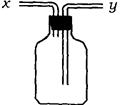
A 瓶内盛液体干燥剂,用以干燥气体
B 瓶内盛液体洗涤剂,用以除去某气体中的杂质
C 瓶内盛水,用以测量某难溶于水的气体的体积
D 瓶内贮存气体,加水时气体可被排出
E 收集密度比空气大的气体
F 收集密度比空气小的气体
(2) 浓H2SO4和木炭在加热时发生反应的化学方程式是_______________________。
图中虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,
填写下列空白。
①A中无水硫酸铜的作用_____________。
②证明SO2一定存在的现象是_____________。
③C中酸性KMnO4溶液的作用_____________。
④证明CO2一定存在的现象是_____________。
为了验证Cu和浓H2SO4反应的产物中有SO2和H2O,选用下图所示仪器(内含物质)组装成实验装置 . B中有无水硫酸铜、C中有品红、D中有氢氧化钠溶液
(1)如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):a接,
接,接;
(2) 仪器B、C应有怎样的实验现象才表明已检验出SO2和H2O?B中,C中;
(3)D中氢氧化钠溶液的作用是
(4)写出A中反应的化学方程式.