某溶液中大量存在以下五种离子:NO3-、SO42-、Fe3+、H+、M,其物质的量浓度之比为c(NO3-):c(SO42-):c(Fe3+):c(H+):c(M)=2:3:1:3:1,则M可能是( )
| A.Al3+ | B.Cl- | C.Mg2+ | D.Ba2+ |
对下列事实的解释正确的是
| A.浓硝酸通常保存在棕色的试剂瓶中,说明浓硝酸不稳定 |
| B.浓硫酸具有吸水性,说明可用浓硫酸干燥氨气 |
| C.足量铁与稀硝酸反应后溶液呈浅绿色,说明稀硝酸不能氧化Fe2+ |
| D.常温下,可用铝制容器盛装浓硫酸,说明浓硫酸与铝不反应 |
各组性质比较的表示中,正确的是
| A.沸点:Cl2<F2<Br2<I2 | B.沸点:HF<HCl<HBr<HI |
| C.氧化性:F2<Cl2<Br2<I2 | D.还原性:HF<HCl<HBr<HI |
下列解释物质用途或现象的反应方程式不准确的是
A.硫酸型酸雨的形成会涉及反应2H2SO3 +O2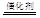 2H2SO4 2H2SO4 |
B.工业上制取粗硅的化学方程式:SiO2+C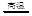 Si+CO2↑ Si+CO2↑ |
| C.Na2S2O3溶液中加入稀硫酸:S2O32-+2H+=SO2+S↓+H2O |
| D.成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl-+ClO-+2H+=Cl2↑+H2O |
下列有关说法错误的是
| A.H2O2、Na2O2都属于过氧化物、都存在非极性共价键 |
| B.H2O2做漂白剂是利用其强氧化性,漂白原理与HClO类似但与SO2不同 |
| C.双氧水是绿色氧化剂,可作医疗消毒剂 |
| D.H2O2既有氧化性又有还原性,1molH2O2在参加反应时一定转移2mol电子 |
下列物质中,不能由单质直接化合生成的是
①CuS②FeS③SO3④H2S⑤FeCl2
| A.①③⑤ | B.①②③⑤ | C.①②④⑤ | D.全部 |