为探究铁与浓硫酸在加热条件下的反应,某活动小组设计并完成以下实验:
(1)实验目的:分析铁与浓硫酸在加热条件下的反应。
①洗气瓶中浓硫酸的作用是 。
②写出加热条件下铁与浓硫酸反应生成SO2的化学方程式 。
活动小组预测随着反应的进行,硫酸的浓度降低,可能还会有氢气产生,为进一步确认气体的成分还需要进行进一步的实验。
(2)实验目的:检验气体的成分。
试剂:氢氧化钠溶液、浓硫酸、氧化铜粉末、无水硫酸铜固体、品红溶液、高锰酸钾酸性溶液、碱石灰。
仪器如下图(可重复使用,可根据需要取用);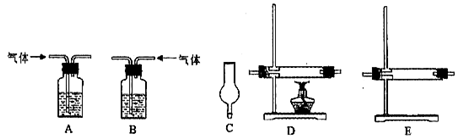
①连接仪器。将装置的字母填入□内,并将试剂名称填写在相应的括号内(可不填满)
②若混合气体中含有氢气,实验过程中能观察到的现象是 。
(3)实验目的:确定产物的含量。
①若混合气体中含有SO2和H2,为测定混合气体中各成分含量,需收集的数据有 。
②若反应后烧瓶中溶液含有的金属阳离子有Fe2+、Fe3+,其中检验是否含有Fe2+可采用的试剂为 ;如果该过程中共消耗了11.2g铁,反应后的溶液能吸收标准状况下1.12L氯气,则原溶液中含有Fe3+的物质的量为 mol。
设计一个实验,能通过观察到明显的现象,说明CO2与NaOH溶液发生了反应。实验用品:集气瓶、烧瓶、分液漏斗、长颈漏斗、导管、橡皮管、弹簧夹、烧杯、量筒、水、CO2气体、NaOH溶液以及你认为所能用到的仪器和药品。现有五位学生装设计了如图所示五个装置,试回答:
(A)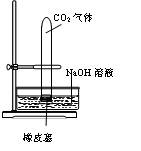 (B)
(B)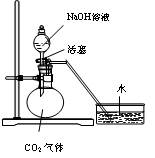
(C)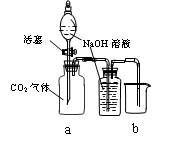 (D)
(D)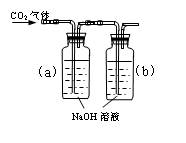
(E)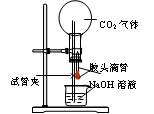
⑴对图A-E,请指出能达到实验目的的装置_______(用A、B、C、D、E填空),并说明能证明CO2与NaOH溶液发生了反应的操作及实验现象,将结果填入下表:
| 装置 |
实验方法 |
实验现象 |
⑵能否设计出其它一些方法来证明CO2与NaOH溶液发生了反应。
新装修的居室内,甲醛浓度往往很大.严重污染空气.居住者接触时间较长易得白血病。1×10—5mol·L—1的紫色KMnO4溶液遇甲醛气体即褪色。用下面的微型化学实验可测定室内空气甲醛含量:
(1) 试设计实验,在中学实验室里配制100mL l.00×10-4mol·L-1KMnO4溶液;
(2) 用2.5mL注射器准确量取2mL l.00×10—4mol·L—1KMnO4溶液,注入六孔穴板1*孔内,加入3滴6 mol·L—1H2SO4溶液,盖好塞子;按图连接好装置。将此装置置于待测地点,缓慢抽气,每次抽气50mL,直到溶液红色褪去,记录抽气次数。已知有关反应为:5HCHO+4KMnO4+6H2SO4 5CO2+11H2O+2K2SO4+4MnSO4
5CO2+11H2O+2K2SO4+4MnSO4
(3) 设抽气次数为n,试计算甲醛在空气中的含量(mg/m3)。
(4) 若室内空气中甲醛气体最高允许浓度为20mg·m-3试分析讨论室内空气符合标准时n的取值范围。
(5) 为保证实验结果精确性,实验过程中应注意什么?
某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示的装置先进行了有关实验:
⑴B是用来收集实验中产生的装置,但未将导管画全,请将装置图补充完整。
⑵实验中他们取6.4g铜片和12mL 18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①请写出铜与浓硫酸反应的化学方程式
②为什么有一定量的余酸但未能使铜片完全溶解?你认为原因是 。
③下列试剂中能够证明反应结束后的烧瓶中确有余酸的是 (填写字母编号)
| A.铁粉 | B.BaCl2溶液 | C.银粉 | D.Na2CO3溶液 |
(3)为了测定余酸的物质的量浓度,甲、乙两位同学进行了如下设计:
①甲同学设计方案是:
先测定铜与浓硫酸反应产生的SO2的量,再计算余酸的物质的量浓度,他认为测定SO2的量的方法有很多种,请问下列实验方案中不可行的是 (填写字母编号)
A:将装置A产生的气体缓缓通过预先称量过的盛有碱石灰的干燥管,结束反应后再次称量
B:将装置A产生的气体缓缓通入足量用稀硫酸酸化的高锰酸钾溶液,再加入足量的氯化钡溶液,过滤、洗涤、干燥,称量沉淀
C:用排水法测定装置A产生气体的体积(已折算成标准状况)
D:将装置A产生的气体缓缓通入足量的氢氧化钡溶液(预先除去了溶解O2),反应完全后,过滤、洗涤、干燥,称量沉淀(隔绝空气条件下)
②乙同学设计的方案是:
在反应后的溶液中加蒸馏水稀释至1000mL,取20mL于锥形瓶中,滴加2~3滴甲基橙指示剂,用标准氢氧化钠溶液进行滴定(已知:Cu(OH)2开始沉淀的pH约为5),通过测定出消耗NaOH溶液的体积来求余酸的物质的量浓度。假定反应前后烧瓶中溶液体积不变,你认为乙同学设计的实验方案能否求得余酸的物质的量浓度 ,(填能或否),其理由是 。
(4)请你再设计一个可行的实验方案来测定余酸的物质的量浓度。简要写出操作步骤及需要测定的数据,并写出相应的计算式。
有常用玻璃仪器组成的下列六种实验装置(根据需要可在其中加入液体或固体)
(1)能用做干燥二氧化硫气体的装置有________(填代号,下同)
(2)既能用于收集氯气又能用于收集一氧化氮气体的装置有________
(3)在氯气和铁反应实验中,能添加在制气和化合反应装置之间以除去氯气中氯化氢等杂质气体的装置有________
(4)在乙烯与溴水反应制二溴乙烷的实验中,能添加在制乙烯装置和加成反应装置之间,达到控制气流使其平衡目的的是________
(5)若用C装置做二氧化硫与烧杯中氢氧化钠溶液反应实验,则其中广口瓶的作用是________
有机物的C、H含量常用燃烧和与CuO灼烧等方法使之生成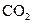 和水,测它们的质量求得有机物中碳和氢的百分含量,现有某固态有机物在加热情况下鼓入足量的氧气使其完全燃烧,今有如下仪器。
和水,测它们的质量求得有机物中碳和氢的百分含量,现有某固态有机物在加热情况下鼓入足量的氧气使其完全燃烧,今有如下仪器。
(1)为确定某固体有机物的最简式(实验式)下述仪器中最少需要的种类有________种,它们是________,其中要一前一后用两次的是________,(填仪器编号)其作用前者为________;后者为________。但为完成测定还缺少的一种重要仪器名称是________。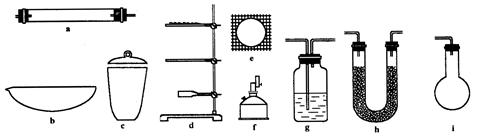
(2)为确定固体有机物是烃还是其含氧衍生物,实验依据是________.
(3)为确定其分子式还需知道下述中的
A. 熔、沸点 B. 定温、定压下蒸气密度
C. 固定有机物的体积 D. 重要的化学性质