探究活动一:在室温条件下进行如图所示实验。已知:试管内的镁条和铁片表面均被打磨洁净,且形状、大小均相同;同时加入两支试管中的稀盐酸的质量和质量分数均相等。
(1) 该实验的目的是、。两支长颈漏斗中产生的现象的不同之处是。
(2)若实验所用的金属均过量,则甲装置中产生的比乙装置中产生的
质量(填"多"、"少"或"相等")。(可能用到的相对原子质量:
-1O-16
-24
-35.5
-56)
探究活动二:为除去铜屑中混有的少量铁屑,并测定该混合物中铁的质量分数,现有如下A、B两组实验方案。

(3)两种方案,你认为不能达到目的的是(填"A"或"B"),理由是。
(4)在你所选取的方案中,若采用加热烘干的方式干燥滤渣,会导致测定的铁的质量分数(填"偏大"、"偏小"、"不变"或"无法判断")。
(1)实验室给你提供了下列仪器,请选用合适的仪器完成指定的实验
①要制取较多的O2用来探究其性质(要求制取过程中可以添加反应物),组装气体发生装置需要的仪器是(填序号),收集氧气应采用法。
②提纯初盐时,过滤需要选用上述仪器中的(填序号),出此之外还缺少的仪器是滤纸、、(填名称)。
(2)美羊羊同学的购物袋装薯片中发现还有一个小袋,上面标有“成分:CaO、Fe;作用:防潮、防氧化;警告:禁止食用”等字样,撕开小袋,发现里面的固体粉末有少许是棕红色,大多数是灰白色的。经过分析,她认为棕红色粉末是Fe2O3,灰白色粉末应该含有CaCO3和Fe,为验证自己的判断,美羊羊同学打算进行实验探究,请你一同参与。
【实验目的】证实灰白色粉末中含有CaCO3和Fe。
【实验设计】装置如下图所示:
【实验预测与分析】
①要证实样品中含有CaCO3,观察到的实验现象是,B中发生反应的化学方程式为。
②若要证实样品中含有Fe,E中应该观察到的现象是,此时C装置的作用是
③看了美羊羊同学的分析结论,有同学认为小袋内灰白色粉末中还应该有别的物质,请你写出其中一种物质的化学式。
在一次学生实验中,学生用带有氧化膜的铝片和稀硫酸反应,发现铝片和稀盐酸、稀硫酸反应发现铝片和稀盐酸反应现象明显,而和稀硫酸几乎不反应。这和“铝能跟稀盐酸或稀硫酸反应生成氢气”不一致,是什么原因呢?是试剂、药品出了问题吗?为了寻找原因,某学生在教师的指导重新用浓盐酸配制了一定浓度的溶液,然后加入一块纯度≥99.5%的铝片验证是否确实存在上述现象,实验结果如下表
无论是用5%H2SO4还是用10%H2SO4,均无明显现象。其结论还是与“铝能跟稀硫酸或稀盐酸反应生成氢气”不相符合。
问题1:为了探索“铝与稀盐酸和稀硫酸反应的差异原因”,你能对问题的答案作出哪些假设或猜想:
假设一:Cl-能
假设二:SO42-能
问题二:为了论证上述假设,你设计的实验方案是:(探究过程)_______________
(12分)下图是实验室中用于制取、干燥和收集气体的装置图。实验课上同学们用过氧化氢溶液与二氧化锰混合制取并收集氧气,试回答: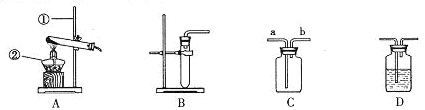
⑴写出A图中带标号仪器的名称:①_______________,②_______________。
⑵用该方法制取氧气的化学方程式是_____________________________________。
⑶该方法制取氧气的发生装置应选择___________,若有C装置采用排水法收集氧气,进气口为____________。(填a或b)
⑷若用D装置干燥氧气,D中应盛放的试剂是___________________。
⑸甲、乙、丙三名同学用所选装置合作实验过程中,胶塞突然弹飞,并有少量的液体溅到实验台和衣服上。就此异常现象三名同学探究如下:
【问题】为什么胶塞会突然弹飞呢?
【查阅资料】①容器内瞬间产生气体过多,压强过大,可能导致胶塞弹飞。
②化学反应速率与反应物的浓度、接触面积、温度、催化剂等因素有关。
【猜想】甲同学:导气管堵塞或弯折造成的。乙同学:过氧化氢溶液用量过多造成的。丙同学:过氧化氢溶液的溶质质量分数过大造成的。
【分析验证】通过检查实验装置发现导气管没有堵塞、弯折的情况;与实验成功的小组同学交流,得知各小组所用过氧化氢溶液溶质的质量分数均相同。于是他们否定了____________两名同学的猜想。请你设计实验,验证另一名同学的猜想是导致本次实验胶塞弹飞的主要原因。
【交流反思】⑴老师建议他们可以通过改进发生装置的方法,避免胶塞弹飞。你对所选的发生装置有何改进设想?(语言叙述或画图均可)
⑵实验结束后,有的同学发现衣服和手上出现有白色的斑点。由此推出过氧化氢溶液还具有的一条性质________________________。
近几年我国某些城市酸雨污染较为严重,主要是因为大量燃烧含硫量高的煤而形成的,此外,各种机动车排放的尾气也是形成酸雨的重要原因。
【提出问题】通过实验证明煤中含有碳元素和硫元素。
【查阅资料】(1)“二氧化硫能使高锰酸钾溶液褪色(由紫红色变为无色),该反应的化学方程式为:5SO2 + 2KMnO4 + 2H2O = K2SO4 + 2MnSO4 + 2 X ”。这个化学方程式中最后一种物质X的化学式是:。
(2)“二氧化硫和二氧化碳一样,也能使澄清石 灰水变浑浊。”请写出二氧化硫与澄清石灰水反应的化学方程式:______________________。
灰水变浑浊。”请写出二氧化硫与澄清石灰水反应的化学方程式:______________________。
根据上述资料,甲同学、乙同学和丙同学分别设计实验方案进行探究。
【实验探究】(3)甲同学:
“实验操作”:甲同学进行了如下图所示A、B两步实验: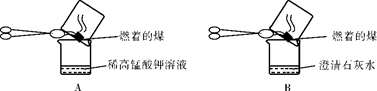
“实验现象”: A中稀高锰酸钾溶液褪色,B中澄清石灰水变浑浊。
“得出结论”:煤燃烧生成二氧化硫和二氧化碳,证明煤中含有碳元素和硫元素。
(4)乙同学认为甲同学的实验方案不合理,其理由是:。
(5)丙同学:“实验操作”:丙同学进行了如下图所示实验(部分装置在图中略去):
【探究与结论】(6)上图C装置的作用是。
(7)要证明煤中含有碳元素和硫元素的现象是:丙同学的实验中。
5月1号起"醉驾入刑"。醉酒的原因是酒中含有一种物质叫乙醇,对人的神经系统有刺激作用。醉酒后驾车会带来严重的社会危害。
(1)乙醇(
)易燃烧,燃烧的化学方程式为。
(2)交警进行呼气酒精检测的原理是:橙色的
酸性溶液遇乙醇迅速生成蓝绿色的硫酸铬,硫酸铬有
和
组成,则硫酸铬的化学式为。
(3)白酒是乙醇的水溶液,酒中乙醇在微生物的作用下能被氧化成乙酸,现有一瓶密封放置了十几年的某种白酒,想知道该白酒的组成情况,设计了如下探究实验:
【提出问题】白酒中溶质有哪些?
【查阅资料】
材料一:乙醇(
),俗称酒精,易溶于水,水溶液呈中性。
材料二:乙酸(
),又名醋酸,易溶于水,具有酸的通性。
【猜想】
猜想1:只有乙醇
猜想2:只有乙酸
猜想3:。
【实验探究】