下列有关实验的操作过程,正确的是 ( )
| A.钠与水的反应:用镊子从试剂瓶中取出金属钠,用小刀切下绿豆粒大小的一粒钠小心放入装满水的烧杯中 |
| B.配制100mL的质量分数10%的H2O2溶液:取一支规格为100mL的量筒,先取质量分数为30%的双氧水溶液33.3mL,然后于加水至100mL刻度线 |
| C.检验某氯化铁溶液中含有Fe2+离子:取该溶液少许,向其中加入KSCN溶液,不变红色;再向其中滴加氯水,溶液变为红色。 |
| D.检验某未知溶液是否含有K+:用洁净的铂丝蘸取少量该溶液,在火焰上灼烧,透过蓝色钴玻璃观察火焰的颜色 |
将1 mol H2(g)和2 mol I2 (g)置于某2L密闭容器中,在一定温度下发生反应:H2(g)+I2(g) 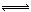 2HI(g);ΔH<0 ,并达到平衡。HI的体积分数ω(HI)随时间变化如图(Ⅰ)所示,若改变反应条件,ω(HI)的变化曲线如图(Ⅱ)所示,则改变的条件可能是 ()
2HI(g);ΔH<0 ,并达到平衡。HI的体积分数ω(HI)随时间变化如图(Ⅰ)所示,若改变反应条件,ω(HI)的变化曲线如图(Ⅱ)所示,则改变的条件可能是 ()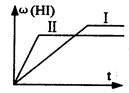
| A.恒温条件下,加入适当催化剂 | B.恒温,恒容下,充入氦气 |
| C.恒容条件下升高温度 | D.恒温,恒压下,充入氦气 |
A、B、C短周期元素在周期表中的位置如图所示,已知A、C可分别与B形成化合物x和y,A与B的质子数之和为C的质子数,现有以下说法,其中判断正确的组合是( )
①B与C均存在同素异形体 ②x的种类比y的多 ③常温下,B氢化物中无H+
④C的最高价氧化物对应水化物能与A的氢化物形成三种盐
A.①②③④ B.②③ C.①②④ D.①④
设NA为阿伏加德罗常数的数值,下列说法错误的是()
| A.NA个Fe(OH)3胶体粒子的质量为107g |
| B.0.1 mol铁在0.1 mol Cl2中充分燃烧,转移的电子数为0.2 NA |
| C.24 g NaH中阴离子所含电子总数为2 NA |
| D.标准状况下,22.4 LCO2和O2混合气体中含有的氧原子数为2NA |
下列说法正确的是()
| A.宏观上的物质对外不显电性,是因为组成它们的微观粒子都是电中性的原子和分子 |
| B.某物质经科学测定只含有一种元素,则可以断定该物质是一种纯净物 |
| C.利用化学方法,我们可以制造出新的分子,但不能制造出新原子 |
| D.由两种元素组成的电解质分子中,显正价的是阳离子,显负价的是阴离子 |
关于化工生产的下列叙述中,不正确的是()
| A.工业生产硫酸时,使用热交换器可以充分利用反应热 |
| B.工业上合成氨没有采用更大的压强是从设备和动力要求方面考虑的 |
| C.电镀精炼铜时,纯铜与直流电源的负极相连 |
| D.工业上金属Mg、Al都是用电解熔融的氯化物制得的 |