(1) 焊接铁轨利用________反应,若用到的原料为铝粉和Fe2O3的混合物,则反应的化学方程式为__________________。
(2) 某人要用汞合金补牙,当他用铝制牙签剔牙以后,发现铝制牙 签部分表面长出白色毛状物,此白色毛状物的化学式为____, 此物质与氢氧化钠溶液反应的离子方程式为_____。
签部分表面长出白色毛状物,此白色毛状物的化学式为____, 此物质与氢氧化钠溶液反应的离子方程式为_____。
已知通常状况下甲、乙、丙、丁等为气体单质,A、B、C、D、E、F、G、H等为化合物,其中A、B、E、G均为气体,C为常见液体。反应①、②、③都是重要的化工反应,反应④是重要的实验室制取气体的反应。有关的转化关系如下图所示(反应条件均已略去)。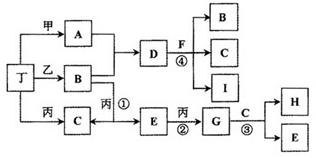
请回答下列问题:
(1)反应④的化学方程式为: ________________________。
(2)B和E在一定条件下可发生反应,这是一个具有实际意义的反应,可消除E对环境的污染,该反应氧化产物与还原产物的物质的量之比为________。
(3)0.1mol lL-1A溶液和0.1mol •L-1B溶液等体积混合,溶液呈________性,原因是(用离子方程式说明) ________________。
(4)请设计实验检验D晶体中的阳离子(简述实验操作、现象和结论):________________。
(5)pH相同的A、D、H三种溶液,由水电离出的c(OH-)的大小关系是(用A、D、H表示) : ____________。
(6)向一定量的Fe、FeO、Fe3O4的混合物中,加入1mol• L-1 A的溶液100 mL,恰好使混合物全部溶解,且放出336mL(标准状况下)的气体,向所得溶液中加入KSCN溶液,溶液无红色出现;若取同质量的Fe、FeO、Fe3O4混合物,加入1 mol • L-1 H的溶液,也恰好使混合物全部溶解,且向所得溶液中加入KSCN溶液,溶液也无红色出现,则所加入的H溶液的体积是________。
铁元素是重要的金属元素,单质铁在工业和生活中使用得最为广泛。铁还有很多重要的化合物及其化学反应。如铁与水反应:3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g) △H
(1)上述反应的平衡常数表达式K=_______。
(2) 已知:①3Fe(s)+2O2(g)=Fe3O4(s)△H1=-1118.4kJ/mol
②2H2(g)+O2(g)=2H2O(g)△H2=-483.8kJ/mol
③2H2(g)+O2(g)=2H2O(l)△H3=-571.8kJ/mol
则△H=_______。
(3)在t0C时,该反应的平衡常数K=16,在2L恒温恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| Fe |
H2O(g) |
Fe3O4 |
H2 |
|
| 甲/mol |
1.0 |
1.0 |
1.0 |
1.0 |
| 乙/mol |
1.0 |
1.5 |
1.0 |
1.0 |
①甲容器中H2O的平衡转化率为_______ (结果保留一位小数)。
②下列说法正确的是_______ (填编号)
A.若容器压强恒定,则反应达到平衡状态
B.若容器内气体密度恒定,则反应达到平衡状态
C.甲容器中H2O的平衡转化率大于乙容器中H2O的平衡转化率
D.增加Fe3O4就能提高H2O的转化率
(4)若将(3)中装置改为恒容绝热(不与外界交换能量)装置,按下表充入起始物质,起始时与平衡后的各物质的量见表:
| Fe |
H2O(g) |
Fe3O4 |
H2 |
|
| 起始/mol |
3.0 |
4.0 |
0 |
0 |
| 平衡/mol |
m |
n |
p |
q |
若在达平衡后的装置中继续加入A、B、C三种状况下的各物质,见表:
| Fe |
H2O(g) |
Fe3O4 |
H2 |
|
| A/mol |
3.0 |
4.0 |
0 |
0 |
| B/mol |
0 |
0 |
1 |
4 |
| C/mol |
m |
n |
p |
q |
当上述可逆反应再一次达到平衡状态后,上述各装置中H2的百分含量按由大到小的顺序排列的关系是
________(用A、B、C表示)。
(5)已知Fe(OH)3的Ksp=2.79×10-39,而FeCl3溶液总是显示较强的酸性,若某FeCl3溶液的pH为3,则该溶液中c(Fe3+)=________mol • L-1 (结果保留3位有效数字)
化合物A ( C8H8O3)是由冬青树的叶经蒸汽蒸馏而得,因此又名冬青油。它常用作饮料、牙裔、化妆品的香料,也用作制取止痛药、杀虫剂等。从A出发有如下图所示转化关系(部分反应产物已略去):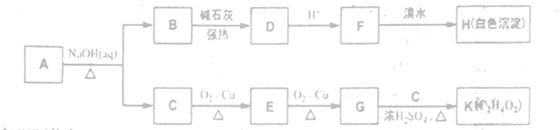
已知以下信息:
①A的核磁共振氢谱表明其有六种不同化学环境的氢,且1molA与溴水反应最多消耗2molBr2。②羧酸盐与碱共热可发反应,如实验室制甲烷:CH3COONa+NaOH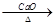 CH4↑+Na2CO3
CH4↑+Na2CO3
回答下列问题:
(1)K的结构简式为________。
(2)B→D的反应方程式为________。
(3)F→H的反应类型为________按系统命名法H的名称为________。
(4)A的结构简式为________。
(5)A的同分异构体中苯环上只有两个取代基且能发生银镜反应和显色反应的共有________种,其中核磁共振氢谱有八种不同化学环境的氢的是________ (写结构简式)。
铁及铁的化合物在生产、生活中有着重要的用途。
(1) 已知铁是26号元素,写出Fe的价层电子电子排布式________。已知自然界丰度最大的铁的同位素是中子数为30的铁原子,则该种同位素符号________。
(2) Fe原子或离子外围有较多能量相近的空轨道,因此能与一些分子或离子形成配合物,则与之形成配合物的分子的配位原子应具备的结构特征是________。Fe(CO)3一种配合物,可代替四乙基铅作为汽油的抗爆震剂,其配体是CO分子。写出CO的一种常见等电子体分子的结构式________;两者相比较,沸点较髙的是________填分子式)。
(3) 1183K以下纯铁晶体的晶胞如图1所示,1183K以上则转变为图2所示晶胞,在两种晶体中最邻近的铁原子间距离相同。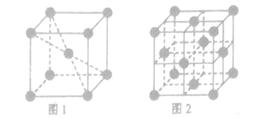
①图1和图2中,铁原子的配位数之比为________。
②空间利用率是指构成晶体的原子、离子或分子在整个晶体空间中占有的体积百分比,则图1和图2中,铁原子的空间利用率之比为________。
琉酸是无机“三大强酸"之一,其产量是衡量一个国家无机化工发展水平的重要标志。工业制硫酸的工艺流程如下图: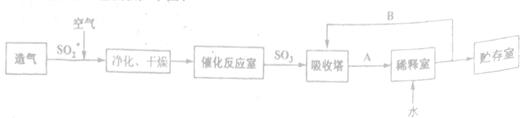
据图回答下列问题:
(1)写出用黄铁矿(主要含FeS2)造气的化学反应方程式________。
(2) 给出A、B物质的名称:A________,B________
(3) 催化氧化之前对SO2和空气的混合气体进行净化、干燥的目的是________ 选用B进入吸收塔吸收SO3的优点是________。
(4) SO2的催化氧化是一个可逆反应,采取适宜的反应条件有利于生产的进行。实际生产中,下列哪些生产条件或措施考虑到了平衡移动原理________ (选填序号)。
A.矿石加入沸腾炉之前先粉碎
B.使用V2O5作催化剂
C.催化反应室中选择400-5000C温度
D.净化后的炉气中要有过量的空气
E. 催化氧化在常压下进行
F. 将尾气中的SO2循环利用
(5) 某硫酸厂每天消耗黄铁矿石(含FeS2质量分動60%) 20吨,生产的三阶段的转化率依次为98%、95%、98%,则该工厂一天能生产B的质量为__________吨。