在标准状况下,由CO和CO2组成的混合气体6.72L,质量为12g、此混合物中CO和CO2物质的量比是______________,CO的体积分数是_____________,CO的质量分数是_____________,C和O原子个数比是____________,混合气体的平均相对分子质量是______________,密度是___________g/L,对氢气的相对密度是____________。
(14分)氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3。请回答下列问题:
(1)Na3N的电子式是_________________________,该化合物由________键形成。
(2)Na3N与盐酸反应生成________种盐,其电子式分别是
________________________________,________________________________。
(3)Na3N与水的反应属于________(填基本反应类型)反应。
(4)比较Na3N中两种粒子的半径:r(Na+)________ (填“>”“=”“<”) r(N3-)。
(14分)分析下图,回答以下问题: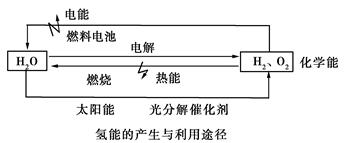
(1)水电解生成H2,首先要解决的问题是________________________________。
(2)氢气作为理想的“绿色能源”除了来源丰富,还有哪些优点:
①________________________________,②_____________________________。
(3)氢氧燃料电池是氢能源利用的一个重要方向,氢气在________极上发生________反应。若电解质溶液为KOH溶液,写出正负极上的电极反应:
正极________________________________,负极________________________________。
(10分)X、Y、Z是三种常见的短周期元素,可以形成XY2、Z2Y、XY3、Z2Y2、Z2X等化合物。已知Y的离子和Z的离子有相同的电子层结构,X离子比Y离子多1个电子层。
(1)X离子的结构示意图为________。
(2)Z2X属于________(共价或离子)化合物。
(3)Z2Y2中含有________键和________键,Z2Y2溶于水时发生反应的化学方程式是_______________。
A、B、C、D、E都是短周期元素,原子半径D>C>A>E>B,其中A、B处在同一周期,A、C 处在同一主族。C原子核内质子数等于A、B原子核内质子数之和,C原子最外层上的电子数是D原子最外层电子数的4倍。试回答:
(1)C在元素周期表的第周期族。
(2)五种元素中,形成最简单的非金属氢化物的稳定性由大到小的顺序是(用分子表示)。
(3)B、D形成的原子个数比为1∶1的化合物的电子式是。
(4)E的一种氢化物叫肼,其分子中E原子与氢原子个数比为1 :2,肼的电子式。肼—空气燃料电池是一种环保碱性燃料电池,其电解质溶液是20%—30%的KOH溶液。该燃料电池的正极的电极反应式是____________。
(1)氢气可由天然气和水反应制备,其主要反应为:
CH4(g)+ 2H2O(g)  CO2(g)+4H2(g)
CO2(g)+4H2(g)
反应过程中能量变化如图所示:
则该反应为反应(填“吸热”或“放热”)。若已知,破坏1mol化学键需要吸收的热量如下代数式表示:
| 化学键 |
C—H |
O—H |
C=O |
H—H |
| 吸收热量(kJ/mol) |
a |
b |
c |
d |
则根据该反应制取1mol H2要吸收或放出热量为kJ(用含a b c d字母表示)。
(2)某温度下,10L密闭容器中充入1.8mol CH4和3mol H2O(g),发生CH4+2H2O(g)  CO2+4H2反应,反应进行到8s时CO2的浓度为0.08mol/L,则:
CO2+4H2反应,反应进行到8s时CO2的浓度为0.08mol/L,则:
①前8s以H2O(g)表示的平均反应速率为;
②8s时,混合气体中H2的体积分数为;