(14分) 0.012Kg 12C所含的碳原子数约为 ① 个;3.01×1023个氢分子的物质的量为 ② mol;标况下,2.24L CO的物质的量为 ③ mol,其中原子数目共有 ④ 个;1g CO与 ⑤ g N2所含分子数相同;同温同压下,同体积的N2和SO2原子总数之比为 ⑥ ,密度之比为 ⑦ 。
(1)请将下列5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
+ + + + H2O
(2)反应物中发生氧化反应的物质是 ,被还原的元素是 。
(3)反应中1 mol氧化剂 (填“得到”或“失去”) mol电子。
(4)请将反应物的化学式及配平后的系数填入下列相应的位置中。

+
氨气与氟气在铜的催化作用下反应得到一种铵盐NH4F和一种含氮化合物A,A的分子结构呈三角锥形,分子中所有共价键之间的夹角都相等。
(1)A的化学式为 ,A的电子式为 。
(2)写出该反应的化学方程式 。
(3)现有1 mol混合气体充分反应后,测得生成物NH4F中的N元素比A中的N元素多2.8 g,试计算原混合气中NH3和F2的物质的量可能各是多少?
等物质的量A、B、C、D四种物质混合,发生如下反应:
aA(?)+bB(?) cC(固)+dD(?)
cC(固)+dD(?)
当反应进行到一定时间后,测得A减少n mol,B减少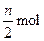 ,C增加
,C增加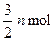 ,
,
D增加n mol,此时达到化学平衡状态.
(1)该化学方程式中各系数为a=________,b=________,c=________,d=________.
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,则该反应中各物质的聚集状态是:A_________,B_________,D_________.
(3)若只升高温度,反应一段时间后,测知四种物质的量又达到相等,则该反应是________反应(填“放热”或“吸热”
今有a盐酸、b硫酸、c醋酸三种酸:
(1)在同体积、同pH的三种酸中分别加入足量的碳酸钠粉末,在相同条件下产生CO2的体积由大到小的顺序是。(填酸的序号,下同)
(2)在同体积、同浓度的三种酸中,分别加入足量的碳酸钠粉末在相同条件下产生CO2的体积由大到小的顺序是。
(3)物质的量浓度均为0.1mol/L的三种酸溶液,pH由大到小的顺序是
下图表示在密闭容器中反应:
2SO2+O2 2SO3△H<0,达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是;b~c过程中改变的条件可能是;若增大压强时,反应速度变化情况画在c~d处.
2SO3△H<0,达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是;b~c过程中改变的条件可能是;若增大压强时,反应速度变化情况画在c~d处.