(1)请将下列5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
+ + + + H2O
(2)反应物中发生氧化反应的物质是 ,被还原的元素是 。
(3)反应中1 mol氧化剂 (填“得到”或“失去”) mol电子。
(4)请将反应物的化学式及配平后的系数填入下列相应的位置中。

+
氮是地球上含量丰富的一种元素,氨、肼(N2H4)和叠氮酸都是氮元素的重要氢化物,在工农业生产、生活中有着重大作用。
(1)合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重要影响。
①在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,其平衡常数K与温度T的关系如下表。
2NH3(g) ΔH<0,其平衡常数K与温度T的关系如下表。
| T/K |
298 |
398 |
498 |
| 平衡常数K |
4.1×106 |
K1 |
K2 |
则该反应的平衡常数的表达式为________;判断K1________K2(填“>”、“<”或“=”)。
②下列各项能说明该反应已达到平衡状态的是________(填字母)。
a.容器内N2、H2、NH3的浓度之比为1∶3∶2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
③一定温度下,在1 L密闭容器中充入1 mol N2和3 mol H2并发生上述反应。若容器容积恒定,10 min达到平衡时,气体的总物质的量为原来的 ,则N2的转化率为________,以NH3的浓度变化表示该过程的反应速率为________。
,则N2的转化率为________,以NH3的浓度变化表示该过程的反应速率为________。
(2)肼可用于火箭燃料、制药原料等。
①在火箭推进器中装有肼(N2H4)和液态H2O2,已知0.4 mol液态N2H4和足量液态H2O2反应,生成气态N2和气态H2O,放出256.6 kJ的热量。该反应的热化学方程式为________________________________________________________________________。
②一种肼燃料电池的工作原理如图所示。该电池工作时负极的电极反应式为_____________________________________。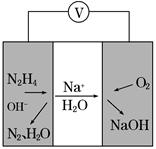
③加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该反应的化学方程式_______________________________________。
肼与亚硝酸(HNO2)反应可生成叠氮酸,8.6 g叠氮酸完全分解可放出6.72 L氮气(标准状况下),则叠氮酸的分子式为________。
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源。由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:
(ⅰ)CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.1 kJ·mol-1
(ⅱ)CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH2=-49.0 kJ·mol-1
水煤气变换反应:
(ⅲ)CO(g)+H2O(g)=CO2(g)+H2(g)ΔH3=-41.1 kJ·mol-1
二甲醚合成反应:
(ⅳ)2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH4=-24.5 kJ·mol-1
回答下列问题:
(1)Al2O3是合成气直接制备二甲醚反应催化剂的主要成分之一。工业上从铝土矿制备较高纯度Al2O3的主要工艺流程是____________________________________________(以化学方程式表示)。
(2)分析二甲醚合成反应(ⅳ)对于CO转化率的影响
________________________________________________________________________。
(3)有研究者在催化剂(含CuZnAlO和Al2O3)、压强为5.0 MPa的条件下,由H2和CO直接制备二甲醚,结果如图所示。其中CO转化率随温度升高而降低的原因是_________________________________________________。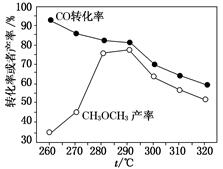
(4)二甲醚直接燃料电池具有启动快、效率高等优点,其能量密度高于甲醇直接燃料电池(5.93 kW·h·kg-1)。若电解质为酸性,二甲醚直接燃料电池的负极反应为__________
_____________________,一个二甲醚分子经过电化学氧化,可以产生________________个电子的电量;该电池的理论输出电压为1.20 V,能量密度E=_______________(列式计算。能量密度=电池输出电能/燃料质量,1 kW·h=3.6×106 J)。
如图所示,某同学设计了一个燃料电池并探究氯碱工业的原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:
(1)甲烷燃料电池负极反应式为________________________。
(2)石墨(C)极的电极反应式为_______________________。
(3)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁极上生成的气体的体积为________L;丙装置中阴极析出铜的质量为________ g。
(4)某同学利用甲烷燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图所示)。
若用于制漂白液,a为电池的________极,电解质溶液最好用)________________
若用于制Fe(OH)2,使用硫酸钠溶液作电解质溶液,阳极选用________作电极。
脱硫技术能有效控制SO2对空气的污染。
(1)向煤中加入石灰石可减少燃烧产物中SO2的含量,该反应的化学方程式是
_______________________________。
(2)海水呈弱碱性,主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42—、Br-、HCO3—等。含SO2的烟气可利用海水脱硫,其工艺流程如图所示: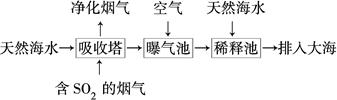
①向曝气池中通入空气的目的是_____________________________________。
②通入空气后曝气池中海水与天然海水相比,浓度有明显不同的离子是________。
a.Cl- b.SO42— c.Br- d.HCO3—
(3)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可得到NaOH,同时得到H2SO4,其原理如图所示(电极材料为石墨)。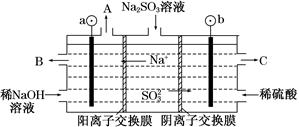
①图中a极要连接电源的________(填“正”或“负”)极,C口流出的物质是________。
②SO32—放电的电极反应式为____________________________。
③电解过程中阴极区碱性明显增强,用平衡移动的原理解释原因:
__________________________________________。
为了提高资源利用率,减少环境污染,化工集团将钛厂、氯碱厂和甲醇厂组成产业链,如图所示。
请填写下列空白。
(1)钛铁矿进入氯化炉前通常采取洗涤、粉碎、烘干、预热等物理方法处理,请从原理上解释粉碎的作用:_______________________________________
已知氯化炉中氯气和焦炭的理论用料物质的量之比为7∶6,则氯化炉中还原剂的化学式是___________________________。
(2)已知:①Mg(s)+Cl2(g)=MgCl2(s)ΔH=-641 kJ/mol
②2Mg(s)+TiCl4(s)= 2MgCl(s)+Ti(s)ΔH=-512 kJ/mol
则Ti(s)+2Cl2(g)=TiCl4(s) ΔH=________。
(3)氩气通入还原炉中并不参与反应,通入氩气的作用是___________________________
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。已知该燃料电池的总反应式为2CH3OH+3O2+4OH-=2CO32—+6H2O,该电池中正极上的电极反应式为_________________________________________。
工作一段时间后,测得溶液的pH________(填“减小”、“增大”或“不变”)。