A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,它们之间有如下的反应关系:
(1)常温下,若A为气态单质,c为非金属氧化物,A、C均能使品红溶液褪色,相对分子质量E>D,则该反应的反应方程式为:_____ ______
检验D中阴离子所用试剂为:
(2)若A为短周期的金属单质,D为气态单质,C溶液呈酸性或强碱性时,该反应都能进行。写出C溶液呈强碱性时反应的离子方程式:
(3)若A、C均为化合物,E为白色沉淀,C为引起温室效应的主要气体,写出E可能的物质的化学式(写两种): , 。
下表列出了部分常见含有10电子和18电子的粒子,回答下列问题。
| 10电子粒子 |
CH4、NH3、H2O、HF、Na+、Al3+、NH4 +、OH- |
| 18电子粒子 |
H2S、HCl、K+ 、Cl-、C2H6…… |
(1)表中-1价的简单离子在周期表中的位置是(周期、族)。其单质有毒,常用强碱溶液吸收,反应的离子方程式为
(2)表中水溶液显碱性的分子的电子式是
写出其催化氧化的化学方程式
(3)写出由表中两种10电子粒子相互反应,生成两种10电子粒子的离子方程式
。
(4)表中在水溶液中能够促进水电离的粒子有
(5)由表中离子组成的NaOH是常用的试剂,下图是配置一定物质的量浓度的氢氧化钠溶液的操作图示,整个过程分为①②③④⑤⑥六个单元。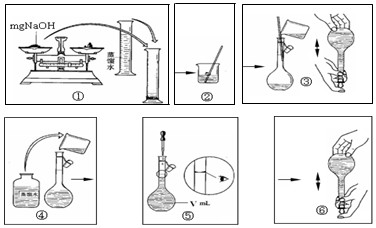
其中操作有错误的单元有(选填①②……)
(6)由第二周期元素形成的氢化物A和B都含有18电子, A是一种6原子分子,可做火箭发动机的燃料,B是一种常见强氧化剂。已知16g液态A与液态B充分反应生成一种液态10电子分子和一种气态单质,并放出838 kJ热量。写出A与B反应的热化学方程式
按要求进行书写:
(1)氯化钡的电离方程式:___________
(2)氢氧化亚铁在空气中被氧化的化学方程式:___________
(3)过氧化钠与水反应的化学方程式:___________
(4)在化学方程式上用双线桥法表示电子转移的方向及数目:
MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
碳酸钠和碳酸氢钠是生活中常见的物质。请回答下列问题。
(1)碳酸氢钠的化学式是___________,俗称___________,其水溶液显___________性(填“酸”、“碱”或“中”)。
(2)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为___________
___________。等物质的量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO2的量,前者___________后者(填“>”、“<”或“=”)。
(3)除去碳酸钠固体中碳酸氢钠的反应的化学方程式为______________________。
现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。

请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A___________、F___________、H___________。
(2)说出黄绿色气体乙的一种用途___________。
(3)反应⑤的离子方程式为____________。
(4)反应过程⑦可能观察到的实验现象___________。
(5)向纯碱溶液中通入气体乙,可制得某种生产生活中常用的漂白、消毒的物质,同时有小苏打生成。该反应的化学方程式为_________________________。
某种芳香族化合物A,其蒸气密度是相同条件下H2密度的82倍。A由碳、氢、氧三种元素组成,经测定碳、氢的质量分数分别为73.2%和7.32%。
(1)A的分子式是。
(2)已知:
ⅰ.  (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)
ⅱ. 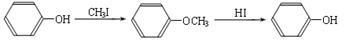
又知,A在一定条件下能发生如下转化,某些生成物(如H2O等)已略去。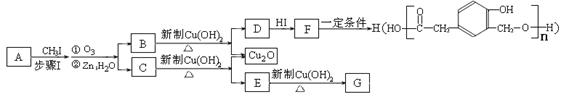
请回答:
①步骤Ⅰ的目的是;
②若G的相对分子质量是44,则E的结构简式是;E的核磁共振氢谱中有个吸收峰(填数字);③ F→H的反应类型是;
④ F在一定条件下可发生酯化反应,生成M(M与FeCl3反应,溶液呈紫色;且分子结构中含有苯环和一个七元环)请写出该反应的化学方程式;
⑤ A的结构简式是;上述转化中B→D的化学方程式是。
(3)已知A的某种同分异构体N具有如下性质:
① N与FeCl3反应,溶液呈紫色;
② N在一定条件下可发生银镜反应,N与H2在苯环侧链上按照物质的量之比1:1作用后的生成物不能发生消去反应;
③在通常情况下,1molN能与含1molBr2的浓溴水发生取代反应;
④ N分子中苯环上的取代基上无支链。
请写出:N可能的结构简式(写一种即可)。