用18.4mol/L的浓硫酸配制lmol/L稀硫酸100mL,其操作有以下各步:
①用量筒量取若干mL浓硫酸
②洗涤烧杯和玻璃棒2-3次,将洗涤液转入容量瓶中
③将稀释、冷却后的硫酸倒入100 mL容量瓶中
mL容量瓶中
④将浓硫酸倒入盛有水的烧杯中稀释、冷却
⑤加水至液面接近刻度线1~2cm处,定容,摇匀
完成下列填空:
⑴第①步操作中应用量筒量取 mL浓硫酸;应选择 mL量筒(填5、10或50)
⑵本实验用到的基本仪器已有烧杯、量筒、玻璃棒,还缺少的仪器是 、 、
。(可以不填写满)
⑶正确的操作顺序是(用序号填写) 。
⑷定容时,如果俯视刻度线,配制的硫酸浓度将偏 (填大或小)。
某自主学习小组用HNO3与大理石反应过程中质量减小的方法,探究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL,大理石用量为10.00g。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 |
T/K |
大理石规格 |
HNO3浓度/mol·L-1 |
实验目的 |
| ① |
298 |
粗颗粒 |
2.00 |
(Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和__探究温度对该反应速率的影响; (Ⅲ)实验①和__探究大理石规格(粗、细)对该反应速率的影响。 |
| ② |
||||
| ③ |
粗颗粒 |
|||
| ④ |
(2)实验①中CO2质量随时间变化的关系见下图:依据反应方程式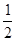 CaCO3+HNO3
CaCO3+HNO3
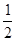 Ca(NO3)2+
Ca(NO3)2+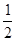 CO2↑+
CO2↑+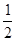 H2O,计算实验①在70-90 s范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程)。
H2O,计算实验①在70-90 s范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程)。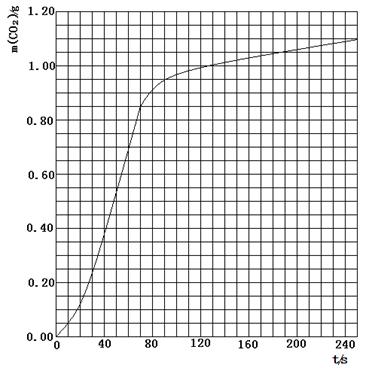
某研究性学习小组设计了一组实验来探究元素周期律。甲同学设计了如图1装置,根据元素非金属性与对应最高价含氧酸之间的关系,可以一次性完成碳族元素中C与Si的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律。A、B、C三处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、蘸有碱液的棉花。已知常温下浓盐酸与高锰酸钾能反应生成氯气。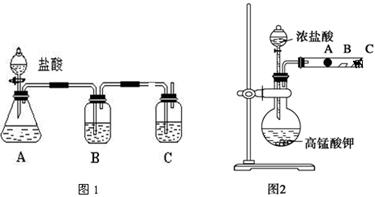
(1)甲同学设计实验的理论依据是_____________________________________;
写出选用试剂分别为:A____________,B__________,C____________;
其中装置B中所盛试剂的作用为_____________________________________;
C中反应的离子方程式为____________________________________________;
(2)乙同学的实验理论依据是______________________________________;
写出A处的离子方程式: ___________________________________________;
B处的现象,C处药品的作用。
某同学用相同质量的锌和相同浓度足量的稀盐酸反应得到实验数据如下
| 实验编号 |
锌的状态 |
反应温度/℃ |
收集100mL氢气所需时间 |
| ① |
薄片 |
15 |
200 |
| ② |
薄片 |
25 |
90 |
| ③ |
粉末 |
25 |
10 |
(1)该实验的目的是研究、对锌和稀盐酸反应速率的影响。
(2)实验①和②表明;
(3)能表明固体的表面积对反应速率影响的实验编号是和。
(4)要加快该反应速率,除了上述表中的因素外,你试举出两条。
某化学兴趣小组的同学设计了一套实验方案探究元素周期表中元素性质的变化规律;同一周期内从左到右元素金属性的递变规律;同一主族内从上到下元素非金属的递变规律。
| 实验方法(Ⅰ) |
实验现象(Ⅱ) |
| 1、钠与冷水反应 |
a、溶液变红色 |
| 2、向NaOH溶液中滴加酚酞 |
b、产生白烟 |
| 3、向新制H2S饱和溶液滴加新制的氯水 |
c、反应不十分剧烈,产生的气体能燃烧,溶液变成浅红色。与酸反应剧烈,产生大量气泡且可以燃烧 |
| 4、镁带在空气中燃烧 |
d、产生大量气泡、气体可以燃烧 |
| 5、NaI溶液中加入溴水和CCl4 |
e、下层溶液变橙色 |
| 6、镁带与沸水反应,再向反应后溶液中滴加酚酞。镁与2mol/L盐酸反应。 |
f、浮于水面,熔成小球,迅速向四处游动 |
| 7、蘸浓氨水与浓盐酸的两玻璃棒接近 |
g、下层溶液变紫色 |
| 8、NaBr溶液中加入氯水和CCl4 |
h、发出耀眼的强光,生成白色物质 |
| 9、铝片与2mnol/L盐酸反应 |
i、生成淡黄色沉淀 |
回答下列问题
(1)从上表(Ⅰ)中选择实验方法,从(Ⅱ)中选择相应的实验现象,上下对应地填写符合要求的答案在空格中(有几个填几个,不一定把空格填满)。
| 1、探究同一周期从左到右元素金属性的递变规律 |
2、探究同一主族内从上到下元素非金属性的递变规律 |
|||||||
| Ⅰ |
||||||||
| Ⅱ |
(2)实验结论(表示元素具体的强弱顺序):
金属性:____________________非金属性:
(3)上表(Ⅰ)中实验方法9反应的离子方程式
(4)上表(Ⅱ)中实验现象e反应的离子方程式
如图所示的仪器装置,在蒸馏烧瓶中装有冰醋酸、乙醇、浓硫酸和沸石,水浴加热,粗制乙酸乙酯。反应一段时间后,将粗产品倒入装有水的烧杯中,液体分为两层,现用两种方法检验乙酸乙酯和水层:第一种方法加入几滴KMnO4溶液,结果两层都没有颜色,无法区别;第二种方法是加入少量碘片,结果是上层液体呈紫红色。
在这个实验中:(1)水浴的作用是,浓硫酸的作用是。
(2)水流经冷凝管时,应从口进入。(填a或b)
(3)烧杯中乙酸乙酯在层,根据是,加入几滴KMnO4溶液后,水层不显紫色,是因为。
(4)粗制乙酸乙酯经过提纯,可得到纯净的酯,提纯的操作方法是。