有一包固体粉末,可能是CaCO3、Na2SO4、CuSO4、Na2CO3中的一种或多种,某实验小组对其组成成分进行了以下探究活动。
【思考与交流】(1)上述物质中,不溶于水的是______①_______(填化学式,下同)。
(2)能溶于水,其水溶液呈蓝色的是______②_______。
【资料查阅】Na2CO3溶液与CuSO4溶液混合能产生蓝色沉淀。
【活动与探究】去一定量上述固体粉末,加足量水溶解。在溶解过程中一定要用到的玻璃仪器有______③_______和玻璃棒,其中玻璃棒的作用是______④_______。
【现象与结论】经上述操作,得到蓝色澄清溶液,则原固体粉末中一定没有____⑤_____和____⑥_____(填化学式)。
【探索与拓展】为进一步确定原固体粉末的组成,该实验小组同学先用托盘天平称取46.2g该粉末,溶于水配成174.6g溶液,再往其中加入溶质质量分数为8%的NaOH溶液,发生如下反应:CuSO4+2NaOH = Na2SO4+Cu(OH)2↓,产生沉淀的质量与所加NaOH溶液质量的关系如图所示。据图回答:(结果保留小数点后一位)
(3)计算产生最大沉淀量时所加NaOH溶液的质量。
(4)通过计算确定46.2g固体粉末的组成。(回答出物质名称和其质量)
(5)计算A点所示溶液中溶质的质量分数。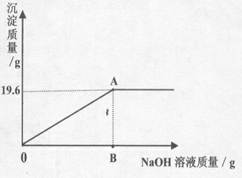
将 146.6 g稀硫酸与5.6g铁粉恰好完全反应,求:
(1)生成氢气生成氢气的质量;(2)反应后所得硫酸亚铁溶液中溶质的质量分数。
用960吨含三氧化二铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁的质量是多少?
在潜水艇中常用过氧化钠(Na2O2)来吸收官兵呼出的二氧化碳气体,并产生氧气,供给人的呼吸,其反应的化学方程式为:2Na2O2+2CO2==2Na2CO3+O2↑。现有质量分数为80%的过氧化钠样品975g与足量的二氧化碳反应,可生成多少克氧气?
课外活动小组的同学在测定由NaCl 和Na2CO3形成的固体混合物组成时,进行了以下实验:取40克固体混合物配成溶液,平均分为4份,然后分别加入一定质量分数的CaCl2溶液,实验数据见下表:
| 实验一 |
实验二 |
实验三 |
实验四 |
|
| 原固体混合物的质量 |
10g |
10g |
10g |
10g |
| 加入CaCl2溶液质量 |
10g |
20g |
30g |
40g |
| 生成的沉淀的质量 |
2g |
m |
5g |
5g |
请分析表中的数据回答并计算:
〔1〕生成的沉淀是〔填写化学式〕
〔2〕10g原固体混合物配成的溶液和足量CaCl2溶液反应,最多生成沉淀质量为
g
〔3〕m = g
〔4〕原固体混合物中Na2CO3的质量分数是多少?
取一定质量的 K2CO3 固体完全溶于水得到100g溶液,加人一定质量溶质质量分数为34.2%的Ba(OH)2溶液,恰好完全反应,过滤,得到BaCO3沉淀19.7g。向所得的滤液中滴入酚酞试液,溶液变红,逐滴加入20g一定溶质质量分数的稀盐酸,溶液刚好变成无色。(涉及到的化学反应为 K2CO3+Ba(OH)2 = BaCO3↓+2KOH )试计算:
(1)所加Ba(OH)2溶液的质量;
(2) 最后所得KCl溶液的溶质质量分数(计算结果保留一位小数)。