25℃时在五份蒸馏水 中分别加入适量的下列物质,所得实验结果如下表所示:
中分别加入适量的下列物质,所得实验结果如下表所示:
| 加入物质 |
HCl(aq) |
FeCl3 |
NaOH |
HCOONa |
C2H5OH |
| 溶液的pH |
3 |
4 |
10 |
11 |
未测定 |
| 水的电离程度 |
α1 |
α2 |
α3 |
α4 |
α5 |
加入物质后水的电离程度由大到小排列顺序正确的是
A.α3>α1>α5>α4>α2 B.α4>α2>α5>α3>α1
C.α2>α4>α5>α1>α3 D.α1>α3>α5>α2>α4
区别下列各组物质的方法错误的是()
| A.甲烷和乙烯:分别通入酸性KMnO4溶液 |
| B.乙醇和乙酸:分别滴加NaOH溶液 |
| C.苯和四氯化碳:分别与水混合、振荡、静置 |
| D.棉花织品和羊毛织品:分别燃烧闻气味 |
同周期的X、Y、Z三种元素,已知其高价氧化物对应的水化物的酸性强弱顺序是:
HXO4>H2YO4>H3ZO4,则下列各判断中正确的是 ( )
| A.原子半径:X>Y>Z | B.单质的非金属性:X>Y>Z |
| C.气态氢化物稳定性:X<Y<Z | D.原子序数:X>Y>Z |
在一定温度下,向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)  2Z(g),此反应达到平衡的标志是
2Z(g),此反应达到平衡的标志是
| A.容器内气体密度不随时间变化 |
| B.v (X): v (Y)= l:2 |
| C.容器内X、Y、Z的浓度不随时间变化 |
| D.单位时间消耗0.1 molX同时生成0.2molZ |
一定条件下,反应4NH3(g)+5O2(g)  4NO(g)+6H2O(g)在5 L密闭容器中进行,10s后H2O的物质的量增加了0.60 mol,则10s内反应的平均速率
4NO(g)+6H2O(g)在5 L密闭容器中进行,10s后H2O的物质的量增加了0.60 mol,则10s内反应的平均速率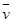 (X)可表示为 ()
(X)可表示为 ()
A.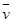 (NH3)=0.008 mol/(L·s) (NH3)=0.008 mol/(L·s) |
B.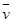 (NO)=0.04 mol/(L·s) (NO)=0.04 mol/(L·s) |
C.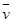 (O2)=0.006 mol/(L·s) (O2)=0.006 mol/(L·s) |
D.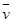 (H2O)=0.06 mol/(L.min) (H2O)=0.06 mol/(L.min) |
海水中含有的氯化镁是镁的重要来源之一。从海水中制取镁有多种生产方法,可按如下步骤进行:①把贝壳制成石灰乳②在引入的海水中加石灰乳,沉降、过滤、洗涤沉淀物③将沉淀物与盐酸反应,结晶、过滤、干燥产物④将得到的产物熔融后电解
关于从海水中提取镁的下列说法不正确的是( )
| A.此法的优点之一是原料来源丰富 |
| B.进行①②③步骤的目的是从海水中提取氯化镁 |
| C.第④步电解制镁是由于镁是很活泼的金属 |
| D.以上制取镁的过程中涉及的反应有分解反应、化合反应和置换反应 |