某次化学兴趣小组活动上,三组学生分别用图示甲、乙两装置,探究“NaHCO3和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查)请回答:
(1)各组反应开始时,______装置中的气球体积先变大,该装置中反应的离子方程式是 。
(2)当试管中不再有气体生成时,三组实验出现不同现象。请参照第①组,分析原因的方式填写下表的空格
肼是重要的化工原料。某探究小组利用下列反应制取水合肼(N2H4·H2O)。
CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl
实验一: 制备NaClO溶液(实验装置如图所示)
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外,还有 (填标号)
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
(2)锥形瓶中发生反应化学程式是 。
(3)利用中和滴定反应原理测定反应后锥形瓶中混合溶液的NaOH的浓度。取一定量锥形瓶内混合溶液稀释一定倍数后,加入适量的H2O2溶液后,再滴加2-3滴甲基橙试液,用0.100mol/L盐酸滴定。需要加入H2O2除去ClO-的原因是 。
实验二: 制取水合肼。(实验装置如图所示)
控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108-114℃馏分(已知:N2H4·H2O易被NaClO氧化,高温易分解)
(4)分液漏斗中的溶液是 (填标号)。
A.CO (NH2) 2溶液 B.NaOH和NaClO混合溶液
选择的理由是 。
蒸馏时需要减压,原因是 。
实验三: 测定馏分中肼含量。
称取馏分5.000g,加入适量NaHCO3固体,加水配成1000mL溶液,移出10.00mL,用0.1000mol·L-1的I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右。
滴定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是能与在滴定过程中产生的 反应。
(6)实验测得消耗I2溶液的平均值为16.40mL,馏分中水合肼(N2H4·H2O)的质量分数为 。
硫酸铜在生产、生活中应用广泛。某化工厂用含少量铁的废铜渣为原料生产胆矾的流程如下:
(1)写出浸出时铜与稀硫酸、稀硝酸反应生成硫酸铜的化学方程式: 。
(2)取样检验是为了确认Fe3+是否除净,你的检验方法是 。
(3)滤渣c是__________。
(4)气体a可以被循环利用,用化学方程式表示气体a被循环利用的原理为2NO+O2=2NO2、 。
(5)一定温度下,硫酸铜受热分解生成CuO、SO2气体、SO3气体和O2气体,且n(SO3)∶n(SO2)=1∶2,写出硫酸铜受热分解的化学方程式: 。
某同学设计了如下图所示的实验装置分别测定生成的SO2、SO3气体的质量和O2气体的体积。此设计有不合理之处,请指出: 。
某学生为了测定部分变质的Na2SO3样品的纯度。按右图所示称取一定量的Na2SO3样品放入A装置的烧瓶中,滴入足量的H2SO4至完全反应;然后,将B中完全反应后的溶液与足量的BaCl2溶液反应,过滤、洗涤、干燥,得白色沉淀23.3g。回答下列问题:
(1)写出A装置中玻璃仪器的名称:酒精灯、______________、______________。
(2)实验开始时,应先点燃__________________处酒精灯(填装置字母)。
(3) 写出D中反应的化学方程式__________________________________。
(4)实验开始后,写出B中反应的离子方程式_______________________。
(5)C中的现象是____________________,E装置的作用是__________________。
(6)原样品中Na2SO3的纯度为__________(精确到0.1%)。按题给装置和操作进行实验,若装置连接和实验操作均无任何问题,该学生测得的Na2SO3的纯度_____(填“偏高”、“偏低”或“无影响”)。
(1)已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验如下(所取溶液体积均为10 mL):
| 实验编号 |
实验温度/℃ |
c(Na2S2O3)/mol·L-1 |
c(H2SO4)/mol·L-1 |
| ① |
25 |
0.1 |
0.1 |
| ② |
25 |
0.2 |
0.1 |
| ③ |
25 |
0.1 |
0.2 |
| ④ |
50 |
0.2 |
0.1 |
| ⑤ |
50 |
0.1 |
0.1 |
其他条件不变时:探究温度对化学反应速率的影响,应选择_______________(填实验编号);
探究浓度对化学反应速率的影响,应选择________________(填实验编号);
若同时选择①②③溶液变浑浊的时间,探究_____________________对化学反应速率的影响。
(2)已知Na2S2O3溶液与Cl2反应时,1mol Na2S2O3转移8mol电子。该反应的离子方程式是_____________________________________________________________________________。
甲同学设计如下实验流程探究Na2S2O3的化学性质。
(Ⅰ)甲同学设计实验流程的目的是证明Na2S2O3溶液具有碱性和_______________性。
(Ⅱ)加入BaCl2溶液生成白色沉淀B的离子方程式是_________________________________。
(Ⅲ)乙同学认为应将上述流程中②③所加试剂顺序颠倒,你认为甲、乙两同学的设计更合理的是____________(填“甲”或“乙”),理由是__________________________________________。
某校课外探究小组欲在实验室条件下制取少量纯净的无水氯化铝。查阅到以下资料:无水氯化铝是白色晶体,易吸收水分,常压下在177.8℃升华,遇潮湿空气即产生大量白雾。用于有机合成和石油工业的催化剂,以及用于处理润滑油等。他们设计了以下装置,请结合题意回答问题:
(1)A装置中发生反应的化学方程式为: 。
(2)装置B的作用是 。
(3)请给标记为F的实线方框选择合适的装置 。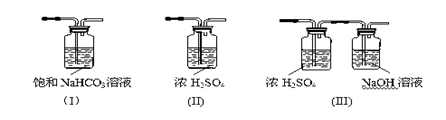
(4)AlCl3遇潮湿空气即产生大量白雾的原因是 (结合化学方程式说明)。
(5)有同学认为装置E中有不足之处,存在安全隐患。若你同意他的观点,请指出其不足之处 。
(6)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度,该小组同学提出酸碱中和滴定法测定方案。方案如下:首先准确量取残余清液稀释一定的倍数后作为试样,平行做了4次滴定。实验中所用NaOH溶液浓度为0.2000mol·L-1,以下是实验记录与数据处理(不考虑NaOH与残液中其他成分的反应)。
| 滴定次数 实验数据ml |
1 |
2 |
3 |
4 |
| V(样品) |
20.00 |
20.00 |
20.00 |
20.00 |
| V(NaOH)(初读数) |
0.00 |
0.50 |
0.70 |
1.00 |
| V(NaOH)终读数) |
22.60 |
22.55 |
22.65 |
23.00 |
①经计算,该次滴定测的试样中盐酸浓度为 mol·L-1。
②在本实验的滴定过程中,下列操作会使实验结果偏小的是 (填写序号)。
a.开始滴定时滴定管尖嘴处留有气泡,滴定结束气泡消失
b.未用标准NaOH溶液润洗滴定管
c.锥形瓶中加入待测盐酸后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
e.滴定前锥形瓶用待测盐酸润洗
f.观察读数时,滴定前仰视,滴定后俯视