某学生为了测定部分变质的Na2SO3样品的纯度。按右图所示称取一定量的Na2SO3样品放入A装置的烧瓶中,滴入足量的H2SO4至完全反应;然后,将B中完全反应后的溶液与足量的BaCl2溶液反应,过滤、洗涤、干燥,得白色沉淀23.3g。回答下列问题:
(1)写出A装置中玻璃仪器的名称:酒精灯、______________、______________。
(2)实验开始时,应先点燃__________________处酒精灯(填装置字母)。
(3) 写出D中反应的化学方程式__________________________________。
(4)实验开始后,写出B中反应的离子方程式_______________________。
(5)C中的现象是____________________,E装置的作用是__________________。
(6)原样品中Na2SO3的纯度为__________(精确到0.1%)。按题给装置和操作进行实验,若装置连接和实验操作均无任何问题,该学生测得的Na2SO3的纯度_____(填“偏高”、“偏低”或“无影响”)。
醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷的装置如下图所示,试管d中装有少量蒸馏水.已知溴乙烷的沸点为38.4oC,密度为1.43g·ml-1;
可能存在的副反应有:加热反应过程中反应混合物会呈现黄色甚至红棕色;醇在浓硫酸的存在下脱水生成烯和醚等。
(1)制备溴乙烷的需要用到蒸馏水、乙醇、溴化钠、浓硫酸,在烧瓶中加入这几种物质的顺序是。
(2)小火加热,在烧瓶中发生的主要反应有①NaBr + H2SO4= NaHSO4 + HBr
②.;
(3)冷水的作用;d试管中的现象,
(4)用这种方法制取的溴乙烷中的含少量杂质Br2,欲除去溴代烷中的少量杂质Br2,下列供选试剂中最适合的是__________。
A.NaI溶液 B.NaOH溶液 C.Na2SO3溶液 D.KCl溶液
(5)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞.请写出发生堵塞时瓶b中的现象________________
(6)容器e中NaOH溶液的作用是__________________________________.
(7)制备操作中,加入的浓硫酸必需进行适当的稀释,其目的是_______。
A.减少副产物烯和醚的生成 B.减少Br2的生成
C.减少HBr的挥发D.水是反应的催化剂
为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
【探究一】
(1)常温下,工业上用铁质容器盛放冷的浓硫酸,其原因是;
(2)称取碳素钢6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选用;
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取560mL(标准状况)气体Y通入足量溴水中,发生SO2+Br2+2H2O===2HBr+H2SO4反应,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g。由此推知气体Y中SO2的体积分数为。
【探究二】
根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1和Q2两种气体,其中Q1气体在标准状况下密度为0.0893g·L-1。为此设计了下列探究实验装置(图中夹持仪器省略,假设有关气体完全反应)。 (3)装置B中试剂的作用是;
(3)装置B中试剂的作用是;
(4)分析Y气体中的Q2气体是如何生成的(用化学方程式表示);
(5)为确认Q2的存在,需在装置中添加洗气瓶M于;
a.A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有Q1,预计实验现象应是。
(共6分)实验室欲配制100mL 0.5mol/L的Na2SO4溶液,试回 答:
答:
(1)实验中用不到的仪器是:;
A.烧杯 B.圆底烧瓶C.100mL容量瓶 D.胶头滴管 E.玻璃棒
(2)配制时应称取Na2SO4g;
(3)在配制一定物质的量浓度溶液的实验中,下列操作会使所配溶液的浓度偏大的是。
A.在烧杯中溶解溶质,搅拌时不慎溅出少量溶液
B.未将洗涤烧杯内壁的溶液转移入容量瓶
C.将配得的溶液从容量瓶转移到干燥、洁净的试剂瓶中时,有少量溅出
D.将烧杯中溶液转移到容量瓶之前,容量瓶中有少 量蒸馏水
量蒸馏水
E.定容时俯视液面
根据镁与二氧化碳的反应推测,钠也能在二氧化碳中燃烧,且固体产物可能为碳酸钠、氧化钠、碳中的两种或三种。某兴趣小组用如下装置开展两个阶段的实验探究。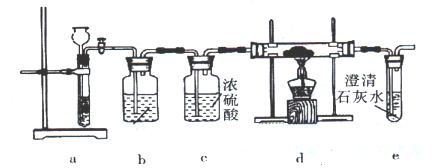
I、引发CO2与Na反应。操作步骤为:①按图连接装置,检验气密性,并往各装置中加入试剂;②打开装置a上活塞一段时间;③点燃d处酒精灯,使CO2与Na充分反应。停止加热,继续通气体使双通直管冷却。回答下列问题:
(1)操作①时,装置b中装入的试剂是;
(2)步骤②时,当观察到时,才能进入步骤③。
Ⅱ:探究反应产物及反应机理。取反应后双通管中固体物质29.2g进行如下实验:
①仔细观察固体,发现有黑色颗粒;
②将固体溶于足量的水并过滤、洗涤,得到1.8 g滤渣(干燥);
③将滤液加水稀释配成250ml的溶液;
④取少量③的溶液,先加足量BaCl2溶液,再加酚酞试液,观察到白色沉淀及溶液变红;
⑤取25.0mL③的溶液,用3.0mol·L-1盐酸滴定,消耗盐酸20.00mL。回答下列问题:
(3)反应后装置d中的固体物质为
(4)通过计算分析:29.2g残留固体中,各组分的质量各是多少?
(5)该探究条件下,钠与二氧化碳反应的化学方程式为。
.二氧化氯(ClO2)是目前国际上公认的第四代高效、无毒的广谱消毒剂,是一种黄绿色的气体,易溶于水。
Ⅰ.(1)ClO2可由KClO3在H2SO4存在的条件下与Na2SO3反应制得。则该反应的氧化产物与还原产物的物质的量之比是 。
Ⅱ.实验室也可用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如下: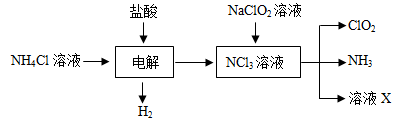
(2)写出电解时发生反应的化学方程式:;
(3)除去ClO2中的NH3可选用的试剂是;(填序号)
| A.饱和食盐水 | B.碱石灰 | C.浓硫酸 | D.水 |
(4)测定ClO2(如图)的过程如下:在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用cmol/L硫代硫酸钠标准溶液滴定 (I2+2S2O32-=2I-+S4O62-),共用去VmL硫代硫酸钠溶液。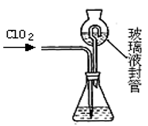
①装置中玻璃液封管的作用是;
②请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式 ;
③滴定终点的现象是:。
④测得通入ClO2的质量m(ClO2)=。(用含c、V的代数式表示)
(5)用ClO2处理过的饮用水(PH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子ClO2—。2001年我国卫生部规定,饮用水的ClO2—含量应不超过0.2mg/L。若饮用水中
ClO2—的含量超标,可向其中加入适量的某还原剂,该反应的氧化产物是(填化学式)。