选择下列实验方法分离物质,将分离方法的序号填在横线上。
| A.萃取分液 | B.升华 | C.结晶 | D.分液 E.蒸馏 F.过滤 |
(1)分离饱和食盐水与沙子的混合物______
(2)从硝酸钾和氯化钠的混合液中获得硝酸钾______
(3)分离水和 汽油的混合物______
汽油的混合物______
(4)分离酒精(沸点为78.1℃)和甲苯(沸点为110.6℃)两种互溶液体___ ___
(5)从碘水中提取碘单质
为探究实验室制乙烯及乙烯和溴水的加成反应。甲同学设计了如图所示的实验装置,并进行了实验。当温度升至170℃左右时,有大量气体产生,产生的气 体通入溴水中,溴水的颜色迅速褪去。甲同学认为达到了实验目的。
体通入溴水中,溴水的颜色迅速褪去。甲同学认为达到了实验目的。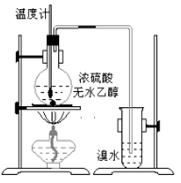
乙同学仔细考察了甲同学的整个实验过程,发现当温度升到100℃左右时,无色液体开始变色,到160℃左右时,混合液全呈黑色,超过170℃后生成气体速度明显加快,生成的气体有刺激性气味。由此他推出,产生的气体中应有杂质,可能影响乙烯的检出,必须除去。据此回答下列问题:
⑴写出甲同学实验中两个反应的化学方程式:
、
。
⑵乙同学观察到的黑色物质是,刺激性气体是。乙同学认为刺激性气体的存在就不能认为溴水褪色是乙烯的加成反应造成的。原因是(用化学方程表示):_____________________。
⑶丙同学根据甲乙同学的分析,认为还可能有CO、CO2两种气体产生。为证明CO存在,他设计了如下过程(该过程可把实验中产生的有机产物除净):发现最后气体经点燃是蓝色火焰,确认有一氧化碳。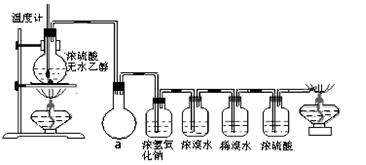
①设计装置a的作用是。
②浓溴水的作用是,
稀溴水的作用是。
.请利用下列装置及试剂组装一套装置。其流程是,先制取纯净干燥的Cl2(不收集),后试验干燥的Cl2和潮湿的Cl2有无漂白性。试回答:

(1)按气体从左向右流向将各装置依次连接起来(填接口标号): a 接_______,______
接______ ,______ 接______ ,______ 接______ ,______ 接h。
(2)烧瓶中发生反应的化学方程式是________________________________________ 。
(3)D装置的作用是____________________ ,E装置的作用是____________________ ,
F装置的作用 是 ________________________。
是 ________________________。
(4)C瓶中的现象是______________________ ,B瓶中的现象是___________________ 。以上事实说明起漂白作用的物质是___________________ 。
.下图为两套实验装置。
(1)写出下列仪器的名称:
① ___________;② ____________。
(2)仪器①~④中,使用时必须检查是否漏水的有。(填序号)
(3)若利用装置I制取蒸馏水,还缺少的仪器有 _____,将仪器补充完整后进行的;实验操作的名称为:,冷却水从口进。
(4)现需配制250 mL 0.2 mol·L—1 NaCl溶液,其中装置II是某同学配制此溶液时转移操作的示意图,图中有两处错误分别是,。
.用98%的浓硫酸(其密度为1.84 g/cm3)配制100 mL 1.0 mol·L-1稀硫酸,若实验仪器有:
| A.100 mL量筒 | B.托盘天平 | C.玻璃棒 | D.50 mL容量瓶 |
E.10 mL量筒 F.胶头滴管 G.50 mL烧杯 H.100 mL容量瓶
(1)需量取浓硫酸的体积为__________mL。
(2)实验时选用的仪器有(填序号)_______________,
(3)配制过程中,下列情况会使配制结果偏高的是(填序号) _______________
①定容时俯视刻度线观察液面②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验。
【实验1】铜与浓硫酸反应,实验装置如图20所示。
实验步骤:
①先连接好装置,检验气密性,加入试剂;
②加热A试管直到B中品红褪色,熄灭酒精灯;
③将Cu丝上提离开液面。
(1)装置A中发生反应的化学方程式为 。
(2)熄灭酒精灯后,因为有导管D的存在,B中的液体不会倒吸,其原因是 。
(3)拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是 。
【实验2】实验中发现试管内除了产生白色固体外,在铜丝表面还产生黑色固体甲 ,其中可能含有氧化铜、硫化铜、硫化亚铜,以及被掩蔽的氧化亚铜。
,其中可能含有氧化铜、硫化铜、硫化亚铜,以及被掩蔽的氧化亚铜。
查阅资料:
①氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在氧气流中煅烧,可以转化为氧化铜。
②硫化铜和硫化亚铜常温下都不溶于稀盐酸,在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫。
为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如图21的实验 :
:
(4)②中检验滤渣是否洗涤干净的实验方法是 。
(5)③中在煅烧过程中一定发生的反应的化学方程式为 。
(6)下列对于固体甲的成分的判断中,正确的是(填字母选 项) 。
项) 。
| A.固体甲中,CuS和Cu2S不能同时存在 |
| B.固体甲中,CuO和Cu2O至少有一种 |
| C.固体甲中若没有Cu2O,则一定有Cu2S |
| D.固体甲中若存在Cu2O,也可能有Cu2S |