.下图为两套实验装置。
(1)写出下列仪器的名称:
① ___________ ;② ____________ 。
(2)仪器①~④中,使用时必须检查是否漏水的有 。(填序号)
(3)若利用装置I制取蒸馏水,还缺少的仪器有 _____ ,将仪器补充完整后进行的;实验操作的名称为: ,冷却水从 口进。
(4)现需配制250 mL 0.2 mol·L—1 NaCl溶液,其中装置II是某同学配制此溶液时转移操作的示意图,图中有两处错误分别是 , 。
取碳酸钠和碳酸氢钠的混合粉末样品22.1g,将其加热到质量不再改变,冷却后称固体质量为15.9g,将得到的15.9g固体配成600mL溶液。则:原样品中碳酸氢钠的物质的量为mol;所配溶液中Na+的物质的量浓度为mol/L。
下图是一个制取氯气并以氯气为原料进行特定反应的装置,其中各试剂瓶装的试剂为:B(AgNO3溶液)、C(氯化亚铁溶液)、D(石蕊试液)、E(浓硫酸)、H(NaOH溶液)。
回答下列问题:
(1)A为氯气发生装置,圆底烧瓶中盛放MnO2,分液漏斗中盛放浓盐酸。反应的化学方程式是。
(2)实验开始时,先点燃A处酒精灯,打开分液漏斗旋塞和Ⅰ处活塞,让氯气充满整个装置,再点燃G处酒精灯。装置B中的现象是;装置D中的现象是;
C中反应的化学方程式是;G中反应的化学方程式是。
(3)G处反应完毕后关闭分液漏斗旋塞,移去酒精灯,但由于余热的作用,A处仍有氯气产生,此时应该怎样操作;装置Ⅰ中的现象是。
(4)热的氯气进入H溶液中,不但有NaClO生成,还有NaClO3生成。若n(NaClO)︰n(NaClO3)﹦1︰2,则氧化剂与还原剂的物质的量比为。
实验室以含有Ca2+、Mg2+、Cl—、SO42—、I—等离子的卤水为主要原料,制备无水CaCl2和I2。流程如下: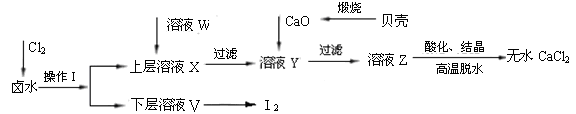
(1)操作Ⅰ的方法是,所用主要仪器的名称是。
(2)加入溶液W的目的是除去SO42-。用CaO调节溶液Y的pH,可以除去Mg2+。酸化溶液Z时使用的试剂是______。从溶液V中再得到I2的操作方法是。
(3)实验室用贝壳与稀盐酸反应制备并收集CO2气体,下列装置中合理的是。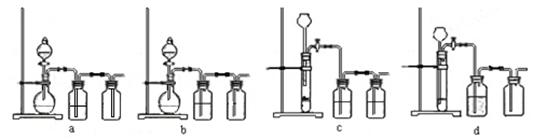
(4)模拟以下净化Cl2流程:Cl2 →饱和NaCl溶液 → 浓H2SO4→纯净Cl2
设计合理实验验证H2SO3酸性强于H2CO3。
供选的试剂:CO2、SO2、Na2CO3溶液、NaHCO3溶液、NaHSO3溶液、蒸馏水、澄清石灰水、酸性KMnO4溶液、品红溶液、pH试纸。
SO2→→ → → 。
某校化学兴趣小组的同学用滴定法对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,回答下列问题:
(1)用分析天平准确称取该样品5.0g,全部溶于水配制成1000.0mL的溶液。用(填一仪器名称)量取其中20.00mL放在锥形瓶中,滴加几滴指示剂,待测。该中和滴定中可选用的指示剂是,(如有几种,可任填一种)滴定终点的现象是。
(2)用0.10mol/L的盐酸溶液滴定未知浓度的NaOH溶液,实验数据如下表所示,
| 实验编号 |
待测NaOH溶液的体积/mL |
HCl溶液的体积/mL |
| 1 |
20.00 |
24.01 |
| 2 |
20.00 |
23.99 |
| 3 |
20.00 |
22.10 |
计算样品中,NaOH的质量百分含量为。
(3)若滴定前,滴定管尖端有气泡,滴定终了气泡消失,将使所测结果(填“偏高”、“偏低”或“不变”,下同),若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,则所测结果;
(4)下图为0.10mol/L 25 mL NaOH溶液中逐滴滴加0.10mol/L CH3COOH溶液过程中溶液pH的变化曲线,请回答:
①B点溶液呈中性,有人据此认为,在B点时NaOH与CH3COOH恰好完全反应,这种看法是否正确?______(选填“是”或“否”)。若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内?________区间.(若正确,此问不答)。
②在D点时,溶液中c(CH3COO-)+c(CH3COOH)______2c(Na+)。(填“>”、“<”或“=”)
(6分)焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置II中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5。
(1)装置I中产生气体的化学方程式为:;
(2)要从装置II中获得已析出的晶体,可采取的分离方法是;
(3)装置III用于处理尾气,可选用的最合理装置(夹持仪器已略去)为(填序号)。