某校化学兴趣小组的同学用滴定法对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,回答下列问题:
(1)用分析天平准确称取该样品5.0g,全部溶于水配制成1000.0mL的溶液。用 (填一仪器名称)量取其中20.00mL放在锥形瓶中,滴加几滴指示剂,待测。该中和滴定中可选用的指示剂是 ,(如有几种,可任填一种)滴定终点的现象是 。
(2)用0.10mol/L的盐酸溶液滴定未知浓度的NaOH溶液,实验数据如下表所示,
| 实验编号 |
待测NaOH溶液的体积/mL |
HCl溶液的体积/mL |
| 1 |
20.00 |
24.01 |
| 2 |
20.00 |
23.99 |
| 3 |
20.00 |
22.10 |
计算样品中,NaOH的质量百分含量为 。
(3)若滴定前,滴定管尖端有气泡,滴定终了气泡消失,将使所测结果 (填“偏高”、“偏低”或“不变”,下同),若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,则所测结果 ;
(4)下图为0.10mol/L 25 mL NaOH溶液中逐滴滴加0.10mol/L CH3COOH溶液过程中溶液pH的变化曲线,请回答:
①B点溶液呈中性,有人据此认为,在B点时NaOH与CH3COOH恰好完全反应,这种看法是否正确?______(选填“是”或“否”)。若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内?________区间.(若正确,此问不答)。
②在D点时,溶液中c(CH3COO-)+c(CH3COOH)______2c(Na+)。(填“>”、“<”或“=”)
下列A~E是初中化学中的五个实验装置,请按要求填空: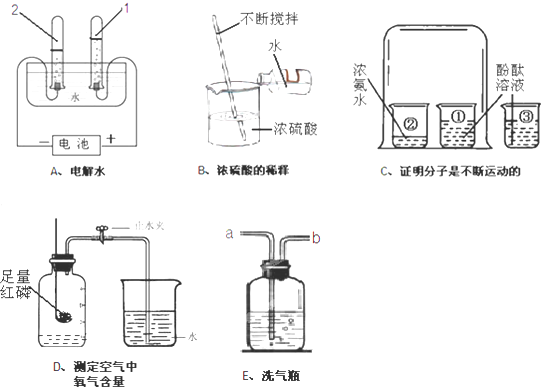
(1)A实验试管2中产生的气体是_________,试管1和2产生气体的体积比约为_________。
(2)C实验中烧杯3的作用是__________________________________________;
(3)D实验说明氧气的体积约占空气的_________,下列操作不妥的是_________。
①检查装置气密性 ②实验前夹紧止水夹
③冷却后再打开止水夹 ④选用教室内的空气
(4)若用E装置除去O2中的水蒸气,该液体试剂为_______,医院还用此装置来观察给病人输氧情况,导管_______(填“a” 或“b”)应连接病人吸氧气的塑胶管。
(5)上述实验中操作错误的是_______________________(填字母)。
在某浓度的NaOH溶液中滴加几滴酚酞试液,溶液立即呈红色,再向其中逐滴加入新制的饱和氯水,当滴到最后一滴时,红色突然褪去.回答下列问题:
(1)产生该现象的原因可能有:
①_________________________________________________________;
②_________________________________________________________.
(2)简述怎样用实验证明红色褪去的原因是①或者是②:_________________________
______________________________________________________.
拟用下图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂).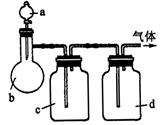
| 气体 |
a |
b |
c |
d |
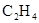 |
乙醇 |
浓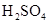 |
 溶液 溶液 |
浓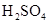 |
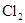 |
浓盐酸 |
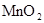 |
 溶液 溶液 |
浓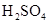 |
 |
饱和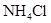 溶液 溶液 |
消石灰 |
 |
固体 |
| NO |
稀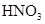 |
铜屑 |
 |
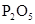 |
(1)上述方法中可以得到干燥、纯净的气体是____________.
(2)指出不能用上述方法制取的气体,并说明理由(可以不填满)
①气体____________,理由是____________.
②气体____________,理由是____________.
③气体____________,理由是____________.
④气体____________,理由是____________.
某兴趣小组欲从工业食盐中精炼精盐,并配制NaCl溶液,请回答下列问题:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。
A B
(2)实验室提纯粗盐的实验操作依次为:
取样、、沉淀、、、冷却结晶、烘干。
(3)实验室配制500 mL 0.1mol/L的NaCl溶液,具体操作步骤为:①在天平上称取一定质量的NaCl,把它放在烧杯中,用适量的蒸馏水使其完全溶解;②把制得的溶液小心的注入500 mL的容量瓶中;③继续向容量瓶中滴加蒸馏水至液面距刻度线1~2 cm处时,改用胶头滴管小心滴加,直到溶液的凹液面恰好与刻度线相切为止;④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次的洗涤液都转入容量瓶中,并轻轻摇匀;⑤将容量瓶塞好,充分摇匀。试填写下列空白。
①应该称取的NaCl的质量为________,上述操作的正确顺序是____________;
②本实验用到的仪器有:玻璃棒、_____________________________________________
________________________________________________________________________,
③观察容量瓶中的液面时,若俯视刻度线,会使所配的溶液的浓度________(填“偏高”“偏低”或“无影响”,下同);没有进行操作④,会________;
(14分)X、Y、Z、W、G、和H均由短周期元素组成,它们是中学化学中常见的气体,具有如下性质:
①X、Y、G能使湿润的蓝色石蕊试纸变红,H能使湿润的红色石蕊试纸变蓝,Z、W不能使湿润的石蕊试纸变色;
②X和H相遇产生白烟;
③Y是形成酸雨的主要气体且能使品红溶液褪色;
④Z和W相遇生成红棕色气体;
⑤G在W中燃烧可以产生Y和H2O;
⑥回答下列问题:
(1) H的化学式是__________,
实验室制取H的化学反应方程式是___________________________________________;
(2)Z的化学式是________,W的化学式是__________________;
(3)⑤中发生反应的化学方程式是___________________________________________;
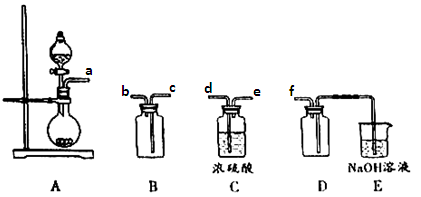
(4)实验室制备、收集干燥的Y气体,所需仪器如下。装置A产生Y气体,按气流方向连接各仪器接口,顺序为a
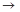 f:
f:
装置D的作用是____,装置E中NaOH溶液的作用是______。