(14分)X、Y、Z、W、G、和H均由短周期元素组成,它们是中学化学中常见的气体,具有如下性质:
①X、Y、G能使湿润的蓝色石蕊试纸变红,H能使湿润的红色石蕊试纸变蓝,Z、W不能使湿润的石蕊试纸变色;
②X和H相遇产生白烟;
③Y是形成酸雨的主要气体且能使品红溶液褪色;
④Z和W相遇生成红棕色气体;
⑤G在W中燃烧可以产生Y和H2O;
⑥回答下列问题:
(1) H的化学式是__________,
实验室制取H的化学反应方程式是___________________________________________;
(2)Z的化学式是________,W的化学式是__________________;
(3)⑤中发生反应的化学方程式是___________________________________________;
(4)实验室制备、收集干燥的Y气体,所需仪器如下。装置A产生Y气体,按气流方向连接各仪器接口,顺序为a
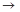 f:
f:
装置D的作用是_ ___,装置E中NaOH溶液的作用是__ ____。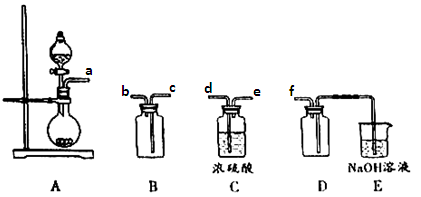
某同学用下面的装置制备并收集纯净的氯化铁,硬质玻璃管E中装有细铁丝网。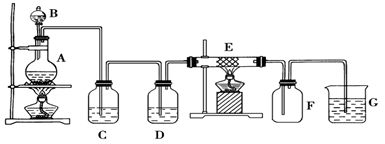
试回答:
(1)检验装置A的气密性的方法是
(2)装置A中反应的化学方程式为
(3)装置C的作用是: ________________,装置D中的试剂是:___________。
(4)可检验装置E中生成的物质中阳离子的方法及现象是。
(5)若把氯气通入石蕊溶液中,观察的现象是:。
(6)装置 G中发生反应的离子方程式为:________________ _____________。
一学习小组利用下图所示装置,对某含少量Fe的废铜屑进行铜含量的测定,并探究利用其制备硫酸铜溶液。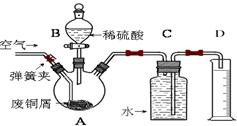
(1)向A中加入10g废铜屑样品,关闭弹簧夹,打开B活塞向A注入足量稀硫酸后关闭。①此时装置C中产生的现象是。
②反应进行到A中不再产生气泡时,若C中收集到448mL(已换算成标准状况)气体,则该废铜屑中铜的质量百分含量为。
(2)接下来使Cu完全溶解的操作是:
① 拆除C、D装置后,打开弹簧夹
②____________________________________________________________________
(3)为使A中固体加快溶解速率,以下方法运用合理的是。
a.对A装置加热;b.向A内加入少量Fe2O3;c.向A内加入少量CuO;d.增大空气通入量;e.向A内加入少量FeSO4;f.向A内加入少量H2O
(4)将A中溶液倒入烧杯内,加入Cu2(OH)2CO3将其调节至pH=4时,溶液中铁元素被完全沉淀,过滤后即得红褐色沉淀与硫酸铜溶液。
①此过程的离子反应方程式是。
②检验溶液中铁元素是否被完全沉淀最好的方法是___________
a.取样于试管→滴加KSCN溶液
b.取样于试管→滴加酸性KMnO4溶液
c.取样于试管→纸上层析后→ 喷KSCN溶液;
(5)有同学认为,可以不用测量气体法计算废铜屑中铜的质量百分含量,其具体操作步骤可续写为:。
Na2SO3在空气中易被氧化而变质。某同学为证明Na2SO3有还原性,从一瓶实验室长期存放的Na2SO3固体中取出少量溶于水,滴入一定量的烧碱溶液和少许溴水,振荡后溶液变为无色。
(1)在碱性溶液中Br2和Na2SO3反应的离子方程式 。
(2)反应后的溶液含有SO32-、SO42-、Br-、OH-等阴离子,下表是某同学鉴定其中SO32-、SO42-和Br-的实验报告,请完成未填完的部分。
限选试剂:2 mol·L-1HCl;1 mol·L-1 H2SO4;l mol·L-1BaCl2;l mol·L-1Ba(NO3)2;1 mol·L-1 KMnO4、CCl4;新制饱和氯水;品红溶液。
| 编号 |
实验操作 |
预期现象和结论 |
| 步骤① |
取少量待测液加入试管中,加入过量2mol·L-1HCl,再滴加适量1 mol·L-1BaCl2 溶液。 |
有白色沉淀生成,证明待测液中含有、SO42- 。 |
| 步骤② |
||
| 步骤③ |
(3)为了测定上述样品的纯度,现取10.0克试样配成250ml溶液。取出25.00ml所配溶液,用0.10mol/L的酸性KMnO4溶液滴定至终点。反应离子方程式为: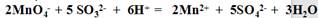
重复操作三次,每次消耗0.10mol/LKMnO4溶液体积分别为20.02 ml、 20.00 ml和19.98 ml。(相对原子质量Na 23 S 32 O 16)
①计算样品中Na2SO3的质量分数为。(结果保留3位有效数字)
②操作时,若未用0.10mol/L的酸性KMnO4溶液润洗滴定管,会导致测定结果。(填“偏高”、“偏低”或“没有影响”)
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g)  2Fe(s)+3CO2(g)ΔH =" a" kJ mol-1
2Fe(s)+3CO2(g)ΔH =" a" kJ mol-1
(1)已知:
①Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g)ΔH1 =" +" 489.0 kJ mol-1
②C(石墨)+CO2(g) = 2CO(g)ΔH2 =" +" 172.5 kJ mol-1
则a =kJ mol-1。
(2)冶炼铁反应的平衡常数表达式K =,温度升高后,K值(填“增大”、“不变”或“减小”)。
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| Fe2O3 |
CO |
Fe |
CO2 |
|
| 甲/mol |
1.0 |
1.0 |
1.0 |
1.0 |
| 乙/mol |
1.0 |
2.0 |
1.0 |
1.0 |
① 甲容器中CO的平衡转化率为。
② 下列说法正确的是(填字母)。
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO的平衡转化率大于乙的
c.甲、乙容器中,CO的平衡浓度之比为2∶3
d.增加Fe2O3可以提高CO的转化率
(4)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。
①在a~c装置中,能保护铁的是(填字母)。
②若用d装置保护铁,X极的电极材料应是(填名称)。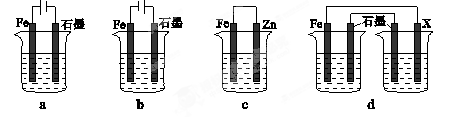
某研究性学习小组利用H2还原法测定两种铜的氧化物CuO、Cu2O混合粉末中铜元素的质量分数。下图是测定装置的示意图,A中的试剂是盐酸。
请回答下列问题。
(1)烧瓶中装入的试剂是锌粒,其中将发生反应的离子方程式是;
(2)试剂C是水,其作用是____;
(3)试剂D是____,其作用是干燥氢气;
(4)连接好装置后的实验操作依次是___(填下列操作序号)
①检验氢气纯度;②加热E;③检验装置气密性;④点燃G管溢出的气体;⑤从A瓶逐滴滴加液体
(5)已知:C(s)+1/2O2( g)= CO(g)△H=-110.5kJ·mol-1,
Cu2O(s) +1/2O2(g) = 2CuO(s)△H=-145 kJ·mol-1
则用炭粉在高温条件下还原CuO生成Cu2O的热化学方程式:____。