高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g)  2Fe(s)+3CO2(g) ΔH =" a" kJ mol-1
2Fe(s)+3CO2(g) ΔH =" a" kJ mol-1
(1)已知:
①Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ΔH1 =" +" 489.0 kJ mol-1
②C(石墨)+CO2(g) = 2CO(g) ΔH2 =" +" 172.5 kJ mol-1
则a = kJ mol-1。
(2)冶炼铁反应的平衡常数表达式K = ,温度升高后,K值 (填“增大”、“不变”或“减小”)。
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| |
Fe2O3 |
CO |
Fe |
CO2 |
| 甲/mol |
1.0 |
1.0 |
1.0 |
1.0 |
| 乙/mol |
1.0 |
2.0 |
1.0 |
1.0 |
① 甲容器中CO的平衡转化率为 。
② 下列说法正确的是 (填字母)。
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO的平衡转化率大于乙的
c.甲、乙容器中,CO的平衡浓度之比为2∶3
d.增加Fe2O3可以提高CO的转化率
(4)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。
①在a~c装置中,能保护铁的是 (填字母)。
②若用d装置保护铁,X极的电极材料应是 (填名称)。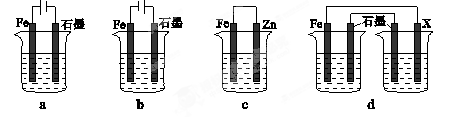
锗及其化合物被广泛应用于半导体、催化剂等领域。以铅锌矿含锗烟尘为原料可制备GeO2,其工艺流程图如下。
已知:GeO2是两性氧化物;GeCl4易水解,沸点86.6℃
(1)第①步滤渣主要成分有(填化学式),实验室萃取操作用到的玻璃仪器有。
(2)第③步萃取时,锗的萃取率与V水相/V有机相(水相和有机相的体积比)的关系如图所示,从生产成本角度考虑,较适宜的V水相/V有机相的值为。
(3)第④步加入盐酸作用(答两点即可)。
(4)第⑤步反应的化学方程式。
(5)检验GeO2·nH2O是否洗涤干净的操作是。
(6)GeO2产品中通常混有少量SiO2。取样品5.4g,测得其中氧原子的物质的量为0.105mol,则该样品中GeO2的物质的量为_____ mol。
(16分)甲、乙、丙三位同学在实验室用不同方法制取氮气。
(1)甲同学让空气通过下图所示装置,以除去氧气制得氮气。硬质玻璃管中所盛固体可选用 (填下列选项标号)
A.铁粉B.碳粉 C.过氧化钠 D.碱石灰
(2)收集氮气可选用 (填下列选项标号)
(3)乙同学设计用氨气和炽热的氧化铜反应制取氮气,反应方程式为 。
(4)制取氨气可选用 (填下列选项标号)
A.加热硫酸铵与氢氧化钙混合物
B.加热分解氯化铵晶体
C.浓氨水滴入氢氧化钠固体
D.加热浓氨水使氨气化
(5)丙同学用加热两种含氮溶液制氮气
NaNO2+NH4Cl  NaCl+N2↑+2H2O
NaCl+N2↑+2H2O
该实验装置需要 、分液漏斗、酒精灯等玻璃仪器。
(6)氮气助燃金属镁,反应方程式: ;燃烧3.6 g镁将消耗标准状况下氮气 mL.
有硫酸酸化的草酸(H2C2O4,二元弱酸)溶液能将KMnO4溶液中的MnO4-转化为Mn2+。某化学小组研究发现,少量MnSO4可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,控制KMnO4溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,完成以下实验设计表。
| 实验 编号 |
温度 |
初始pH |
0.1 mol/L草酸溶液/mL |
0.01mol/LKMnO4溶液体积/mL |
蒸馏水 体积/mL |
待测数据(反应混合液褪色时间/s) |
| ① |
常温 |
1 |
20 |
50 |
30 |
t1 |
| ② |
常温 |
2 |
20 |
50 |
30 |
t2 |
| ③ |
常温 |
2 |
40 |
__________ |
______ |
t3 |
(2)该反应的离子方程式_______________________________。
(3)若t1<t2,则根据实验①和②得到的结论是_______________________________。
(4)请你设计实验验证MnSO4对该反应起催化作用,完成下表中内容。
| 实验方案(不要求写出具体操作过程) |
预期实验结果和结论 |
_________________________ |
_________________________ |
(5)化学小组滴定法测定KMnO4溶液物质的量浓度:取ag草酸晶体(H2C2O4•2H2O,摩尔质量126g/mol)溶于水配成250mL溶液,取25. 00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定两次,平均消耗KMnO4溶液VmL。滴定到达终点的现象是: _______________________;实验中所需的定量仪器有________________(填仪器名称)。该KMnO4溶液的物质的量浓度为_______mol/L。
氨基甲酸铵(NH2COONH4)是一种白色固体,受热易分解。某小组模拟制备氨基甲酸铵,反应如下(且温度对反应的影响比较灵敏):2NH3(g)+CO2(g) NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0
(1)如用下图I装置制取氨气,可选择的试剂是。
(2)制备氨基甲酸铵的装置如下图Ⅱ所示,把NH3和CO2通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵的小晶体悬浮在CCl4中。当悬浮物较多时,停止制备。
注:CCl4与液体石蜡均为惰性介质。
① 发生器用冰水冷却的原因是,液体石蜡鼓泡瓶的作用是。
②从反应后的混合物中分离出产品的实验方法是(填写操作名称)。为了得到干燥产品,应采取的方法是(填写选项序号)。
a.常压加热烘干 b.高压加热烘干 c.减压40℃以下烘干
(3)制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种。
①设计方案,进行成分探究,请填写表中空格。
限选试剂:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、稀盐酸。
| 实验步骤 |
预期现象和结论 |
| 步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解。 |
得到无色溶液 |
| 步骤2:向试管中加入过量的BaCl2溶液,静置 |
若溶液不变浑浊,证明固体中不含碳酸铵。 |
| 步骤3:向试管中继续加入 。 |
,证明固体中含有碳酸氢铵。 |
②根据①的结论:取氨基甲酸铵样品3.95 g,用足量氢氧化钡溶液充分处理后,过滤、洗涤、干燥,测得沉淀质量为1.97 g。则样品中氨基甲酸铵的物质的量分数为。[Mr(NH2COONH4)=78、Mr(NH4HCO3)=79、Mr(BaCO3)=197]
我市某地的煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用工艺设计如下: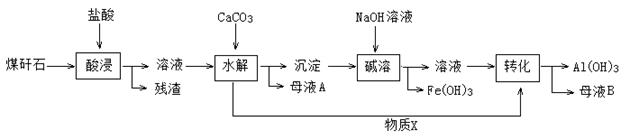
已知:
| 离子 |
开始沉淀pH |
完全沉淀pH |
| Fe3+ |
2.1 |
3.2 |
| Al3+ |
4.1 |
5.4 |
请回答下列问题:
(1)“酸浸”后得到的残渣中主要含有的物质是_________。物质X的化学式为_______。
(2)“酸浸”时影响铝浸出率的因素可能有(写出两个)____________、__________。
(3)为了获得产品Al(OH)3,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续操作过程是____________________。
(4)Al(OH)3可添加到塑料中作阻燃剂的原因是。
(5)以Al和MnO2为电极,与NaCl和稀氨水电解质溶液组成一种新型电池,放电时MnO2转化为MnO(OH)。该电池反应的化学方程式是。
(6)预处理后的100t煤矸石经上述流程后,得到39t纯度为95%的氢氧化铝产品。则预处理后的100t煤矸石中铝元素的回收率为。