某学习小组在探究
与
溶液反应的实验中,先用铝制易拉罐收集满一罐
气体,然后迅速向其中加入一定量的
浓溶液,立即将易拉罐口封闭(不漏气),轻轻摇动易拉罐,发现易拉罐很快变瘪,但过一段时间后,易拉罐又重新鼓起来(反应过程中温度的变化忽略不计)。
【提出问题】易拉罐为什么先瘪后鼓?
【分析猜想】易拉罐开始时变瘪的原因是
【查阅资料】①
具有较强的热稳定性,只有在高温条件下才会分解;
②铝单质比较容易被酸、碱腐蚀。
【设计方案并进行实验】为了检验铝制易拉罐中重新生成的气体成分,小组又进行如下实验,并记录了相应的实验现象:
| 实验步骤 |
实验现象 |
实验结论 |
| ①将易拉罐口打开,迅速用燃着的木条伸入罐口。 |
发出"噗"的一声,产生淡蓝色火焰,片刻后熄灭。 |
说明罐中重新生成的气体A是 |
| ②取少量铝片于试管中,先加入适量的水,片刻后再加入少量的氢氧化钠溶液。 |
先加水,没有明显变化,后加入氢氧化钠溶液后产生无色无味的气体。 |
说明铝是否与水直接反应 |
| ③取少量易拉罐中反应后的溶液于试管中,加入过量的稀盐酸。 |
产生了无色无味气体,该气体能使澄清石灰水变浑浊。 |
说明原
气体被
溶液吸收 |
【实验结论】①铝制易拉罐变瘪的原因是
被
溶液吸收,②铝制易拉罐重新鼓起的原因是铝与
溶液反应产生了气体。
【反思评价】小组根据实验探究获得一条对金属铝化学性质的新认识:
【拓展延伸】
与
溶液反应产生了气体的同时还生成另一种书写形式类似于
的盐,请完成下列反应化学方程式:
以下是某研究小组探究影响化学反应快慢的一些因素的相关数据(常温通常指20℃;“浓度”指溶质的质量分数)
| 实验序号 |
过氧化氢溶液浓度/% |
过氧化氢溶液质量/g |
温度/℃ |
二氧化锰用量/g |
氧气体积/ml |
反应所需时间/s |
| ① |
5 |
12 |
20 |
0.2 |
125 |
11 |
| ② |
30 |
12 |
20 |
0.2 |
125 |
2 |
| ③ |
30 |
12 |
40 |
/ |
125 |
148 |
| ④ |
30 |
12 |
90 |
/ |
125 |
82 |
(1)通过实验①和②对比可知,化学反应快慢与有关;
(2)通过对比实验和可知,化学反应快慢与温度的关系是。
(3)由上述实验可知,实验室用过氧化氢制取氧气的最合适的条件是 。
某研究小组在学习氧气的化学性质时发现:铁丝在氧气中燃烧没有火焰,而蜡烛在氧气中燃烧却有明亮的火焰。该小组同学进行了如下探究。
(1)写出铁丝在氧气中燃烧的文字表达式:。
(2)探究一:蜡烛燃烧产生火焰的原因是什么?
点燃蜡烛,将金属导管一端伸入内焰,导出其中物质,在另一端管口点燃,也有火焰产生(如图所示)。由此可知:蜡烛燃烧产生的火焰是由(填“固态”或“气态”)物质燃烧形成的。
(3)探究二:物质燃烧产生火焰的根本原因是什么?
【查阅资料】
| 物质 |
熔点╱℃ |
沸点╱℃ |
燃烧时温度╱℃ |
| 石蜡 |
50∽70 |
300∽550 |
约600 |
| 铁 |
1535 |
2750 |
约1800 |
| 钠 |
97.8 |
883 |
约1400 |
由上表可知:物质燃烧能否产生火焰与其(填“熔点”或“沸点”)和燃烧时温度有关。通过上表中石蜡、铁的数据对比,你认为物质燃烧时,什么情况下能产生火焰。由此推测:钠在燃烧时,(填“有”或“没有”)火焰产生。
(4)根据硫在空气或氧气中燃烧的实验事实,请你推测硫沸点硫燃烧时的温度(填“>”或“<”或“=”)
化学是以实验为基础的自然科学,通过实验现象的观察和分析得到结论。结合下列实验回答问题。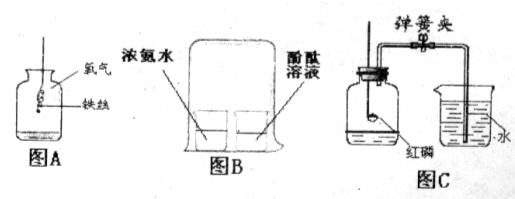
图A所示实验集气瓶中的现象是:铁丝在氧气中剧烈燃烧,__________,放出大量的热,有黑色固体生成,该反应的符号表达式是_____________。
图B所示实验可观察到酚酞溶液由________色变为__________色,该实验中没有涉及的性质是_________(填字母)。
A.氨分子是不断运动的 B.氨分子有一定质量 C.浓氨水具有挥发性
图C所示实验用于测定空气中氧气的含量。红磷在空气中燃烧的符号表达式是______________,关于该实验的下列说法中正确的是__________(填字母)。
A.实验时红磷一定要足量B.点燃红磷前先用弹簧夹夹紧乳胶管
C.红磷熄灭后立刻打开弹簧夹 D.最终进入瓶中水的体积约为氧气的体积
E. 该实验必须检查装置的气密性
乙炔(C2H2)气体和氧气反应能产生高温火焰,工人师傅常用氧炔焰切割或焊接金属。乙炔由碳化钙(块状固体,化学式为CaC2)与水反应生成,同时生成一种白色固体。
【查阅资料】电石主要成分为碳化钙(CaC2),它没有可燃性。
【提出问题】白色固体是什么物质?
【做出猜想】小明经过思考认为有以下几种可能:
猜想一:CaO;猜想二:;猜想三:Ca(OH)2。
他的依据是。
【交流反思】经过同学们交流讨论,认为猜想一不成立。否定猜想一的理由是:
。
【进行实验】
(一)取少量白色固体放入试管中,滴加稀盐酸,没有观察到,证明猜想二不成立。
(二)取少量白色固体加入到水中,取上层清液,通入,有白色浑浊出现,证明猜想三成立。该反应的化学方程式为:。
结论:白色固体是Ca(OH)2。
【拓展应用】某市一辆满载电石的货车遇大雨引发熊熊大火,其中的可燃物是________,且该反应放出大量热,使可燃物达到_______________。
【交流反思】通过上述实验可知,电石在保存和运输时的注意事项__________________
小明、小华、小林和小军四位位同学利用下图所示装置在实验室制取O2和CO2,并对它们的有关性质进行研究,请回答下列问题。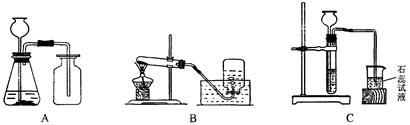
(1)小明同学用KMnO4固体制取O2,应选用上图中的装置(填编号),该反应的化学方程式为;该反应的基本反应类型__________当O2收集满并取出集气瓶后,停止该实验的正确操作方法是__________
(2)小华同学用浓HCl(具有挥发性)与大理石在C装置中反应,制取CO2并检验其有关性质,观察到烧杯中紫色石蕊试液变红,对这一现象的解释不合理是(填序号)。
a.产生的CO2直接使石蕊试液变红
b.产生的CO2与H2O反应生成H2CO3,使石蕊试液变红
c.挥发出的氯化氢溶于水,使石蕊试液变红
(3)小林同学用A装置制取氢气,他需要做的改动是__________________,点燃氢气前一定要_______________________。写出氢气燃烧的化学方程式__________________。
(4)小军也用A装置制取氧气,分别倒入适量的6%、15%的双氧水,再加入等量的MnO2,各收集一集气瓶气体,发现浓度大的先收集满。由此可以得出,其它条件相同时,化学反应速率与反应浓度的关系是__________________。