在化学反应中,如果反应前后元素的化合价发生变化,就一定有 转移,这类反应就属于 反应。元素化合价升高,表示该元素的原子 电子,含该元素的物质发生 反应,这种物质是 剂;元素化合价降低,表明该元素的原子 电子,含该元素的物质发生 反应,这种物质是 剂。
某待测溶液(阳离子为Na+)中只可能含有 、
、 、Cl-、Br-、
、Cl-、Br-、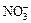 、
、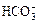 中的一种或若干种,进行下列实验(每次实验所加试剂均足量):
中的一种或若干种,进行下列实验(每次实验所加试剂均足量):
回答下列问题: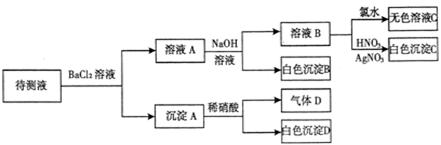
(1)待测液中是否含 、
、 离子
离子
(2)气体D的化学式为,反应生成沉淀B的离子方程式为:
(3)根据以上实验,待测液中肯定没有的离子;肯定存在的离子是。
下图所示装置为铜跟浓硫酸反应制取二氧化硫的实验装置,请回答下列问题:
Ⅰ.(1)盛放药品前,检验此装置的气密性的操作方法和现象是:
_______________
(2)在装置A中放入有关药品后,打开活塞K,将分液漏斗中的液体加入烧瓶中,关闭分液漏斗的活塞,点燃酒精灯,烧瓶中反应的化学方程式为:
(3)装置D中试管口放置的棉花中应浸有一种液体,这种液体是其作用是:
(4)装置B的作用是贮存多余的二氧化硫和防止其污染环境,则B中应盛放的液体是(填写字母代号)________;
a.水 b.浓溴水; c.KMnO4酸性溶液 d.NaHSO3饱和溶液
Ⅱ.两位同学设计了下述两个方案,并都认为如果观察到的现象和自己设计的方案一致,即可确证无色混合气体中含有CO2和SO2.
试评价上述各方案是否严密,并说明理由:
。
(1) 下列有关实验操作或判断不正确的是 _________
A.用10 mL量筒量取稀硫酸溶液 8.0 mL B.用干燥的pH试纸测定氯水的pH
C.用碱式滴定管量取KMnO4溶液 19.60 mL
D.使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度偏大
E.圆底烧瓶、锥形瓶、蒸发皿加热时都应垫在石棉网上
(2)根据右图描述回答下列问题:
①关闭图A装置中的止水夹a后,从长颈漏斗向试管中注入一定量的水,静置后如图所示。试判断:A装置是否漏气?(填序号)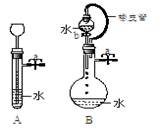
A.漏气 B.不漏气 C.不能确定
②关闭图B装置中的止水夹a后,开启活塞b,水不断往下滴,直至全部流入烧瓶。试判断:B装置是否漏气?(填序号)A.漏气 B.不漏气 C.不能确定
已知:2Fe + 3Br2 = 2FeBr3,Fe2+的还原性大于Br-现有16.8g铁和0.3molBr2反应后加入适量水后,通入amolCl2。
①.当a≤0.15时,反应离子方程式为
②.当Fe2+与Br-同时被氧化时,a的取值范围为
③.当a=0.3时,反应后氧化产物与还原产物的物质的量之比为比
A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1∶2。在一定条件下,各物质之间的相互转化关系如右(图中部分产物未列出):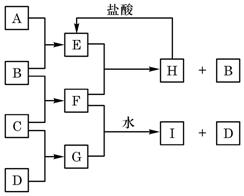
请填写下列空白:
①.A是,C是。
②.H与盐酸反应生成E的化学方程式是。
③.E与F反应的化学方程式是。
④.F与G的水溶液反应生成I和D的离子方程式是。