实验室配制480 mL 0.600 mol·L-1的NaCl溶液,有如下操作步骤:
①把称量好的NaCl晶体放入小烧杯中,加适量蒸馏水溶解
②把①所得溶液小心转入容量瓶中
③继续向容量瓶中加蒸馏水至液面距刻度线1 cm~2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀
⑤将容量瓶瓶塞塞紧,充分摇匀
请填写下列空白:
(1)操作步骤的正确顺序为(填序号) 。
(2)实验室有如下规格的容量瓶:①100 mL,②250 mL,③500 mL,④1000 mL,本实验选用(填序号) 。
(3)本实验用到的基本实验仪器除容量瓶、玻璃棒外,还有 。
(4)需要使用玻璃棒的操作有 (填步骤序号),其作用为 。
(5)误差分析:(填“偏高”“偏低”或“无影响”)
①称量NaCl时,物码倒置(1 g以下用游码) 。
②某同学观察液面的情况如右图所示,对所配溶液浓度将有何影响 。
③没有进行操作步骤④ 。
④加蒸馏水时不慎超过了刻度线,立即用胶头滴管将多余的水吸出 。
⑤容量瓶中原来有少量水 。
(15分)向一个体积可变的密闭器中充入4molA、1molB,发生如下反应:
4A(g)+B(s)  3C(s)+4D(g)。在高温下达到平衡,测得混合气体中D的浓度为0.3mol·L-1。
3C(s)+4D(g)。在高温下达到平衡,测得混合气体中D的浓度为0.3mol·L-1。
请填写下列空白:
(1)若容器体积为10L,反应经2min达平衡,则以A物质浓度变化表示的化学反应率为
。
(2)若压缩容器增大压强,则逆反应的速率,容器中D的体积分数。(填“增大”“减小”“不变”)
(3)若相对分子质量M(B)>3M(C),温度升高时混合气体的平均相对分子质量减少,则正反应。(填“吸热”或“放热”)
(4)在最初的容器改充1.5molC、4.4molD温度保持不变,要使反应达平衡时D的浓度为0.6mol·L-1,则容器的体积是L。
(16分)已知 —C(OH)2—不稳定. 由丙烯经下列反应可得到F、G两种高分子化合物,它们都是常用的塑料。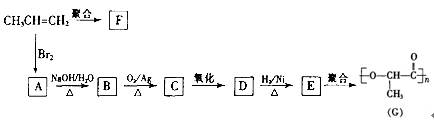
(1)聚合物F的结构简式是。
(2)D的结构简式是。
(3)B转化为C的化学方程式是
(4)在一定条件下,两分子E能脱去两分子水形成一种六元环状化合物,该化合物的结构简式。
(5)写出 C 与新制备的银铵溶液反应的化学方程式
(6)写出同时符合下列条件:①含有—OH的酯②水解产物稳定(一个碳原子上接两个羟基,存在―O―O-键的物质不稳定)
属于D的同分异构体的结构简式:
A、B、C、D均为短周期元素。A、B可形成两种液态化合物,其最简式分别为BA和B2A。A与D可形成气态化合物DA、DA2。A、B、D可组成离子化合物,该晶体化学式为B4A3D2,其水溶液呈弱酸性。B与D可形成一种极易溶于水的碱性气体X。B与C可形成极易溶于水的酸性气体Y。已知X分子与B2A分子中的电子数相等。Y分子与最简式为BA的分子中的电子数相等。请回答:
(1)写出元素的名称:A,C。
(2)Y分子是(填极性和非极性)分子。
(3)写出C2+ X(过量)→ D反应的化学方程式。
(4)B4A3D2水溶液呈酸性,写出其呈酸性的离子方程式
(5)已知液态X与B2A相似,也可以发生微弱的电离,电离出含相同电子数的离子,则X的电离方程式为:
(6)D元素最高价氧化物对应的水化物的溶液与D元素最高价氧化物的水化物和它的氢化物所形成的化合物的溶液的PH均为5(室温下),则两溶液中水电离出的氢离子的个数之比:。
(1)写出铝热法炼铁的化学方程式
(2)氢氧燃烧电池是一种高效低污染的新型电池,主要用于航天领域。它的电极材料一般为活化电极,具有很强的催化活性,如铂电极、活性炭电极等。电解质溶液一般为40%的KOH溶液。请写出电极反应式:
负极: ______________________________
正极: ______________________________
(3)在中国古代的《淮南万毕术》里,就有湿法炼铜:"曾青得铁则化为铜"的记载。曾青又名空青、白青、石胆、胆矾等,其实都是天然的硫酸铜。请根据“湿法炼铜”的反应设计一个原电池装置,在右边方框中画出原电池的装置图,标出正、负极和电解质溶液。
(1)下面列出了几组物质,请将物质的合适组号填写在空格上。互为同位素的是;互为同分异构体的是;互为同素异形体是;互为同系物的是。
①淀粉和纤维素;②D2O与T2O; ③12C和14C;④金刚石与石墨;⑤CH4和异丁烷;⑥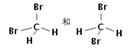 ;⑦葡萄糖和果糖;
;⑦葡萄糖和果糖;
(2)写出下列分子的电子式
含有2个原子核、18个电子的单质分子
含有6个原子核、16个电子的分子