碳、氢、氧3种元素组成的有机物A,相对分子质量为102,含氢的质量分数为9.8%,分子中氢原子个数为氧原子的5倍。
⑴ 求A的分子式
⑵一定条件下,A与氢气反应生成B,B分子的结构可视为1个碳原子上连接2个甲基和另外2个结构相同的基团。
①A的结构简式是  ,其官能团的名称是
,其官能团的名称是
②A不能发生的反应是(填写序号字母)
a.取代反应 b.消去反应 c.酯化反应 d.还原反应
⑶写出两个与A具有相同官能团、并带有支链的同分异构体的结构简式: 
⑷ A还有另一种酯类同分异构体,该异构体在酸性条件下水解,生成两种相对分子质量相同的化合物,其中一种的分子中有2个甲基,此反应的化学方程式是
⑸ 已知环氧氯丙烷可与乙二醇发生如下聚合反应: B也能与环氧氯丙烷发生类似反应生成高聚物,该高聚物的结构简式是
B也能与环氧氯丙烷发生类似反应生成高聚物,该高聚物的结构简式是
(10分)小王同学准备用CuSO4·5H2O配制500 mL 1 mol/L的溶液。
(1)小王同学选用的容量瓶容积的规格是mL;
(2)玻璃棒在该实验中有重要的用途,分别是和 ;
(3)小王同学通过计算,用托盘天平称取g CuSO4·5H2O。
(4)配制好的溶液呈色。小王同学还想通过实验证实溶质中含有SO42-,请你帮他想想办法,选择适当的试剂,并写出其相应的实验步骤、现象以及离子方程式。
| 溶质 |
实验步骤 |
实验现象 |
离子方程式 |
| SO42- |
(5)物质的量浓度误差分析:(填偏高、偏低、无影响)
①若容量瓶中洗净后未干燥,残留少量水,则所配制的溶液浓度将;
②定容时,若眼睛俯视,则所配制的溶液浓度将。
(8分)分别用一种试剂将下列物质中混入的少量杂质除去(括号内为混入的杂质)
| 物质 |
需加入的试剂 |
有关离子方程式 |
| HNO3(H2SO4) |
||
| Cu(Fe) |
||
| ZnSO4(CuSO4) |
||
| NaCl(Na2CO3) |
(10分)(1)写出下列物质在水溶液中的电离方程式
氯化铜______________硫酸铁______________
(2)下列物质:①Na ② H2O ③酒精 ④CO2 ⑤NH3 ⑥Cu(OH)2⑦Ba(OH)2 ⑧冰醋酸(纯净的醋酸) ⑨蔗糖 ⑩NaCl溶液 ⑪BaSO4。
属于电解质的是, 属于非电解质的是 。(填序号)
(3)已知浓度为0.01mol·L-1的HCl溶液VmL,加水稀释到2VmL,取出10mL,则这10mL溶液中c(H+)mol/L。
(5分)选择下列实验方法分离物质,将分离方法的序号填在横线上。
A 萃取分液 B 蒸发结晶 C.分液 D.蒸馏 E、过滤
(1) 分离饱和食盐水和沙子的混合物。
(2) 分离水和汽油的混合物。
(3) 分离CCl4(沸点为76.75○C)和甲苯(沸点为110.6○C)的混合物。
(4) 将碘从碘水中提取出来。
(5) 从硫酸钾溶液中得到硫酸钾固体。
实验室配制500mL 0.2mol/L的FeSO4溶液,实验操作步骤有:
①在天平上称出27.8g绿矾,把它放在烧杯里,用适量的蒸馏水使它完全溶解
②把制得的溶液小心地注入500mL容量瓶中
③继续向容量瓶中加蒸馏水至液面距刻度1~2cm处.改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀
⑤将容量瓶塞塞紧,充分摇匀
请填写下列空白:
(1)操作步骤的正确顺序为(填序号).
(2)本实验用到的基本仪器已有烧杯、天平(带砝码、镊子)、玻璃棒,还缺少的仪器是
、.
(3)某同学观察液面的情况如图所示,对所配溶液浓度有何影响?会(填“偏高”、“偏低”或“无影响”).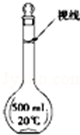
(4)若出现如下情况,所配溶液浓度将偏高还是偏低:没有进行操作步骤④,会;加蒸馏水时不慎超过了刻度,会.向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面,会.
(5)若实验过程中出现如下情况应如何处理?加蒸馏水时不慎超过了刻度,应.