(10分)
现用质量分数为36.5%、密度为1.20 g·cm-3的浓盐酸来配制100 mL 1.5 mol/L的稀盐酸。可供选择的仪器有:①玻璃棒②烧瓶③烧杯④胶头滴管⑤量筒⑥容量瓶⑦托盘天平⑧药匙。请回答下列问题:
(1)上述仪器中,在配制稀盐酸时用不到的有 (填代号)。
(2)经计算,需浓盐酸的体积为 。
现有①10 mL ②20 mL ③50 mL ④100 mL四种规格的量筒,取用浓盐酸应选用的量筒是 (填代号)。
(3)在配制过程中,其他操作都准确,下列操作中:错误的是 ,能引起误差偏高的有 (填序号)。
①洗涤量取浓盐酸后的量筒,并将洗涤液转移到容量瓶中
②稀释后的盐酸在空气中放置过久
③定容时,加蒸馏水超过标线,又用胶头滴管吸出
④转移前,容量瓶中含有少量蒸馏水
⑤定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑥定容时,俯视标线
污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某化学研究小组利用软锰矿(主要成分为MnO2,另含有少量头铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已略去)。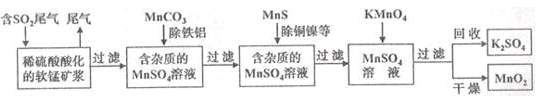
请回答下列问题:
(1)上述流程脱硫实现了____(选填下列字母编号)。
A.废弃物的综合利用
B.白色污染的减少
C.酸雨的减少
(2)用MnCO3能除去溶液中Al3+和Fe3+,其原因是_____。
(3)已知:25℃、101kpa时,Mn(s)+O2(g)=MnO2(s)△H=-520kJ/mol
S(s)+O2(g)=SO2(g) △H=-297kJ/mol
Mn(s)+S(s)+2O2(g)=MnSO4(s)△H=-1065kJ/mol
SO2与MnO2反应生成无水MnSO4的热化学方程式是________________。
(4)MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是____________________________。
(5)MnO2是碱性锌锰电池的正极材料。碱性锌锰电池放电时,正极的电极反应式是____________________________________。
(6)假设脱除的SO2只与软锰矿浆中的MnO2反应。按照图示流程,将a m3(标准状况)含SO2的体积分数为b%的尾气通入矿浆,若SO2的脱除率为89.6%,最终得到MnO2的质量为c kg,则除去铁、铝、铜、镍等杂质时,所引入的锰元素相当于MnO2___________kg。
金属冶炼和处理常涉及氧化还原反应。
(1)由下列物质冶炼相应金属时采用电解法的是 ,
a.Fe2O3b.NaClc.Cu2Sd.Al2O3
(2)辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2==4CuSO4+2H2O,该反应的还原剂是 ,当1mol O2发生反应时,还原剂所失电子的物质的量为 mol。向CuSO4溶液中加入镁条时有气体生成,该气体是 。
(3)下图为电解精炼银的示意图, (填“a”或“b”)极为含有杂质的粗银,若b极 有少量红棕色气体产生,则生成该气体的电极反应式为 ,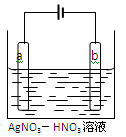
(4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为 。
锂离子电池的应用很广,其正极材料可再生利用。某锂离子电池正极材料有钴酸锂(LiCoO2)、导电剂乙炔黑和铝箔等。充电时,该锂离子电池负极发生的反应为6C+xLi++xe- = LixC6。现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件未给出)。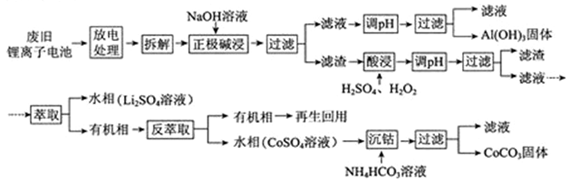
回答下列问题:
(1)LiCoO2中,Co元素的化合价为 。
(2)写出“正极碱浸”中发生反应的离子方程式 。
(3)“酸浸”一般在80℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式 ;可用盐酸代替H2SO4和H2O2的混合液,但缺点是 。
(4)写出“沉钴”过程中发生反应的化学方程式 。
(5)充放电过程中,发生LiCoO2与Li1-xCoO2之间的转化,写出放电时电池反应方程式 。
(6)上述工艺中,“放电处理”有利于锂在正极的回收,其原因是 。在整个回收工艺中,可回收到的金属化合物有 (填化学式)。
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
CH3CH=CH2+CO+H2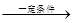 CH3CH2CH2CHO
CH3CH2CH2CHO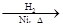 CH3CH2CH2CH2OH;
CH3CH2CH2CH2OH;
CO的制备原理:HCOOH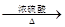 CO↑+H2O,并设计出原料气的制备装置(如图)
CO↑+H2O,并设计出原料气的制备装置(如图)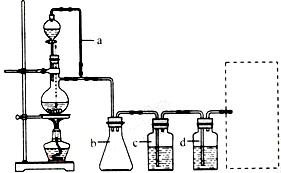
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备氦气,丙烯。写出化学方程式: , 。
(2)若用以上装置制备干燥纯净的CO,装置中a和b的作用分别是 , ;
C和d中承装的试剂分别是 , 。若用以上装置制备H2气体发生装置中必需的玻璃仪器名称是 ;在虚线框内画出收集H2干燥的装置图。
(3)制丙烯时,还产生少量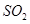 ,
,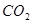 及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是________________(填序号)
及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是________________(填序号)
①饱和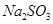 溶液
溶液
②酸性 溶液
溶液
③石灰水
④无水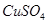
⑤品红溶液
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是______________。
a. 低温、高压、催化剂 b. 适当的温度、高压、催化剂
c. 常温、常压、催化剂 d. 适当的温度、常压、催化剂
(5)正丁醛经催化剂加氢得到含少量正丁醛的1-丁醇粗品,为纯化10-丁醇,该小组查阅文献得知:
①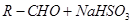 (饱和)→
(饱和)→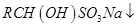 ;
;
②沸点:乙醚34°C,1-丁醇118°C,
并设计出如下提纯路线: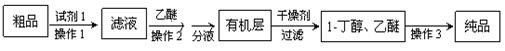
试剂1为_________,操作1为________,操作2为_______,操作3为_______。
(2013年新课标1)醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下: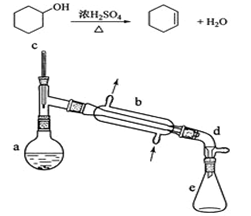
可能用到的有关数据如下: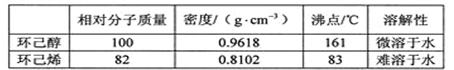
合成反应:
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸。B中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10g。
回答下列问题:
(1)装置b的名称是 。
(2)加入碎瓷片的作用是 ;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作时 (填正确答案标号)。
A.立即补加B.冷却后补加C.不需补加D.重新配料
(3)本实验中最容易产生的副产物的结构简式为 。
(4)分液漏斗在使用前须清洗干净并 ;在本实验分离过程中,产物应该从分液漏斗的 (填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是 。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有 (填正确答案标号)。
A.圆底烧瓶
B.温度计
C.吸滤瓶
D.球形冷凝管
E.接收器
(7)本实验所得到的环己烯产率是 (填正确答案标号)。
A.41%B.50%C.61%D.70%