下图为某市售盐酸试剂瓶标签上的部分数据。问:
(1)该盐酸的物质的量浓度为多少?
(2)取该盐酸25.4 mL与2.00 mol·L-1的氢氧化钠
溶液100 mL混合,再将混合液稀释到1.00 L,
此时溶液的pH约为多少?
完成下列方程式(要注明反应条件)。
①甲烷与氯气反应制一氯甲烷:________________________②乙烯使溴水褪色:_______________
③苯和液溴混合加铁粉 :__________________④制备乙酸乙酯:_________________________________
有下列几组物质或微粒:
| A.11H和21H | B.甲烷和乙烷 | C.红磷和白磷 | D.金刚石、石墨和C60 |
E.丁烷和异丁烷F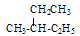 和
和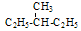 其中,属于同分异构体的是______;属于同位素的是______;属于同素异形体的是_______;属于同一种物质的是________;属于同系物的是_________。(填字母编号)
其中,属于同分异构体的是______;属于同位素的是______;属于同素异形体的是_______;属于同一种物质的是________;属于同系物的是_________。(填字母编号)
将露置于空气中的某氢氧化钠固体样品溶于水,向所得溶液中逐滴加入稀盐酸至过量,生成的CO2体积(标准状况)与加入的盐酸体积有如图关系(不考虑CO2在水中的溶解)。试计算:(无需书写计算步骤)
(1)盐酸的物质的量浓度为mol/L。
(2)该样品中NaOH与Na2CO3物质的量之比为。
次磷酸钠(NaH2PO2)可用于化学镀镍。
(1)化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性条件下发生以下镀镍反应:
①Ni2+ + H2PO2-+ → Ni+H2PO3-+
② 6H2PO2- +2H+ →2P+4H2PO3-+3H2↑
请配平反应式①。
(2)反应式①中还原剂是,被还原元素是。
(3)反应②中,若生成1 mol H2PO3-,反应中转移电子的物质的量为mol。
(4)从二个反应分析,若生成1mol Ni和1mol P,同时有mol H2PO3-生成。
(5)完成下列各小题中的化学反应方程式:
碱金属与O2反应生成氧化物较复杂,有普通氧化物(如K2O)过氧化物(如K2O2)还有超氧化物和臭氧化物等。要制备碱金属的普通氧化物一般是用碱金属还原对应的过氧化物、硝酸盐或亚硝酸盐。写出下列化学反应式:
①钠与过氧化钠反应
②钾还原硝酸钾,同时还产生了一种单质气体
将分别含有甲、乙两种常见金属元素的两种正盐A和B的混合物溶于水,通入氯气,然后向反应后的溶液中加入四氯化碳并振荡、静置,溶液分层,下层液体呈橙红色。若在该混合物的溶液中滴加一定浓度的氨水至过量,可得到白色沉淀C。向沉淀C加入过量NaOH溶液,沉淀部分溶解,剩余白色沉淀D。将D溶于盐酸,可得到A溶液;将D灼烧可得到优质的耐高温材料。
(1)试写出A和B的化学式:A,B。
(2)元素乙的单质可与某黑色固体反应置换出熔融态的铁,写出该反应的化学方程式:。