呋喃甲醇和呋喃甲酸是有机合成中的常用试剂,可用呋喃甲醛制备,其实验原理为: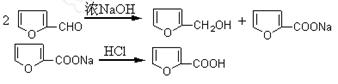
制备方法如下:①在50mL烧杯中放置3.28mL(0.04mol)呋喃甲醛,并用冰水冷却;称取1.6gNaOH溶于少量水中,在搅拌下滴加氢氧化钠水溶液于呋喃甲醛中。②在8~12℃下连续搅拌40min。③向反应混合物加入适量水使其恰好完全溶解,用乙醚萃取分液。④乙醚萃取物用无水硫酸镁干燥后,先在水浴中蒸去乙醚,然后蒸馏,收集169~172℃馏分得1.4g产品。⑤在乙醚提取后的水溶液中慢慢滴加浓盐酸到pH=3,搅拌,冷却,结晶,抽滤。⑥产物用少量冷水洗涤,抽干后,收集粗产物。再提纯后得精产品1.5g。
(1)本实验中,氢氧化钠必须溶于少量的水,否则水量过大主要会影响__________收率。
(2)本实验中要充分连续搅拌40min,其目的是______________________________。
(3)萃取时,用到的主要硅酸盐质的仪器是__________;抽滤的优点是______________________________________________________________________。
(4)呋喃甲酸粗产品提纯的方法是________________________________________。
(5)本实验中呋喃甲酸的产率为________________________________________ 。
某校化学实验小组欲帮助环保局配制480 mL 0.5 mol/L的NaOH溶液,用于当地水质检测。试回答相关问题:
(1)该小组同学选择________ mL的容量瓶。
(2)其操作步骤如图Ⅰ所示,则如图Ⅱ所示操作应在图Ⅰ中的________(填选项字母)之间。

| A.②和③ | B.①和② | C.④和⑤ | D.③和④ |
(3)该小组同学应称取NaOH固体________g
(4)下列操作对所配制溶液的浓度大小有何影响?
①转移完溶液后未洗涤玻璃棒和烧杯,浓度________(填“偏大”、“偏小”或“无影响”,下同)。
②容量瓶中原来有少量蒸馏水,浓度________。
(8分)下图是硫酸试剂瓶标签上的内容:
(1)该硫酸的物质的量浓度是________mol/L。
(2)某化学兴趣小组进行硫酸性质的实验探究时,需要240 mL 4.6 mol/L的稀硫酸,则需要取________mL的该硫酸。将上述硫酸进行稀释的实验操作是_____________________。
(3)在配制4.6 mol/L的稀硫酸的过程中,下列情况对硫酸溶液物质的量浓度有何影响(填“偏高”、“偏低”或“无影响”)
①未经冷却趁热将溶液注入容量瓶中________;
②容量瓶用1 mol/L稀硫酸润洗________;
③定容时仰视观察液面________。
(4)常温下,某学生取出少量试剂瓶中的硫酸于一洁净试管中,加几片铝,结果铝片表面没有气泡产生,也未发现铝片溶解,试帮助该同学分析原因______________________。
信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为_______________________________;得到滤渣1的主要成分为___________________。
(2)第②步加H2O2的作用是________________,使用H2O2的优点是
;调溶液pH的目的是使生成沉淀。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是。
(4)由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案:
上述三种方案中,_______方案不可行,原因是_____________________________;从原子利用率角度考虑,________方案更合理。
(5)探究小组用滴定法测定CuSO4·5H2O (Mr=250)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用cmol·L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL。滴定反应如下:Cu2++H2Y2-=CuY2-+2H+
写出计算CuSO4·5H2O质量分数的表达式w= ________________ ;下列操作会导致CuSO4·5H2O含量的测定结果偏高的是_____________。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
(16分)某校学生课外活动小组的同学设计下图所示实验装置,用来验证一氧化碳具有还原性.回答下列问题.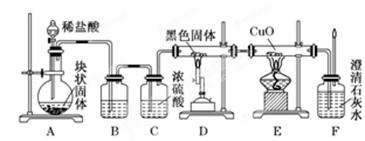
(1)写出装置A中所发生反应的离子方程式____________________________________.
(2) B中最适宜的试剂是__________________________________________________.
(3)若实验中没有装置C,使装置B与装置D直接相连,会对实验造成的影响是:________________________________________.
(4)装置D中黑色固体为________(填名称),反应的化学方程式为________________.
(5)按照如图装置进行实验时,首先进行的操作是_______________________.
(6)根据实验中的______________________现象,可证明CO具有还原性,有关反应的化学方程式是____________________________________.
(7)若要根据装置F中澄清石灰水变浑浊的现象确认一氧化碳具有还原性,应在上图装置________与________之间连接下图中的________装置(填序号).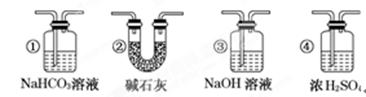
某同学称取了4.0 gNaOH固体,欲配制100 mL溶液。回答下列问题:
(1)该实验中,用到的能确定体积的两种玻璃仪器是________、________。
(2)操作过程中多次用到玻璃棒,其在实验中的作用有_____。
(3)不规范的实验操作会导致实验结果的误差。分析下列操作对实验结果的影响(填“偏大”、“偏小”或“不变”):
①在溶解过程中有少量液体溅出烧杯外________;
②定容时仰视仪器上的刻度线________;
③定容后,将容量瓶振荡摇匀后,静置发现液面低于刻度线,于是又加入少量水至刻度线________。
(4)最后所得的溶液应存放在试剂瓶中,并贴上标签,请你填写该标签(如图)。