(12分)饮用水消毒的主要目的是杀灭可引起霍乱、伤寒、痢疾等疾病的病菌,含氯消毒剂由于杀菌力 强,价格低等优点,一直是当今世界上应用最广泛的一种杀菌剂,为人类的健康立下了汗马功劳。回答下面各小题。
强,价格低等优点,一直是当今世界上应用最广泛的一种杀菌剂,为人类的健康立下了汗马功劳。回答下面各小题。
(1)氯气是一种 色、具有刺激性气味、 (填“无”或“有”)毒的气体。
(2)在水灾后,卫生防 疫部门向广大居民发放了漂粉精,用于饮用水的杀菌消毒,漂粉精的有效成分是 。
疫部门向广大居民发放了漂粉精,用于饮用水的杀菌消毒,漂粉精的有效成分是 。
(3)用化学方程式表示工业生产漂粉精的反应原理 。
(4)已知H2CO3的酸性比HClO强,若把漂粉精暴露在空气中,请你推测会发生什么反应,写出反应的化学方程式 ,根据这一特性,漂粉精的保存方法为 。
(14分)
现有A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B原子的最外层电子数之和与C原子的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物常温下均为液态.请回答下列问题(填空时用实际物质的化学式表示):
(1)C与F两种元素形成一种化合物分子,各原子最外层达8电子结构,则该分子的结构式,其空间构型为.
(2)科学家制出另一种直线型气态化合物 B2D2分子,且各原子最外层都满足8电子结构,则B2D2电子式为.
(3)C4分子结构如题26图所示,已知断裂lmol C-C吸收167kJ热量,生成1mo1C≡C放出942kJ热量.则下列说法正确的是.
① C4属于一种新型的化合物② C4沸点比P4(白磷)低
③ lmol C4气体转变为C2吸收882kJ热量④ C2与C4互为同素异形体
⑤ C4与C2互为同分异构体
(4)已知A2(g)与C2(g)一定条件下反应生成0.5mol CA3(g)放出23kJ的热量,写出该反应的热化学方程式.
(5)为了除去化合物乙(A2ED4)的稀溶液中混有的A2ED3,常加入氧化剂A2D2,发生反应的离子方程式为:.
已知:格氏试剂是用卤代烃和镁在醚类溶剂中反应制得,它在有机合成上应用广泛。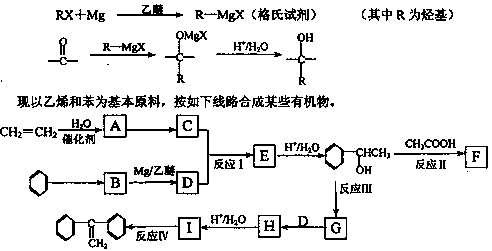
回答下列问题:
(1)C的结构简式__________。
(2)反应I的类型是__________。
(3)反应III的条件是__________。
(4)写出下列反应的化学方程式(要求注明反应条件)。
反应Ⅱ:______________________________;
反应Ⅳ:______________________________。
(5)G的同分异构体中,含有苯环且能发生银镜反应的有机物有_____种,请写出其中一种的结构简式为:_______________。
A、B、C、D是四种常见的单质,A、B为金属,C、D常温下是气体,其中D为黄绿色。甲、乙、丙为常见的化合物。它们之间的转化关系如下图所示:
回答下列问题:
(1)化合物乙的名称__________。
(2)B与甲反应的化学方程式是____________________。
(3)由丙的饱和溶液可以制得胶体,胶体中粒子直径的大小范围是__________;若要提纯该胶体,采用的操作方法叫_____。如果用该胶体做电泳实验,___极附近颜色加深。
(4)将A、B两种金属按一定的质量比组成混合物。
①取一定质量的该混合物,向其中加入足量的NaOH溶液,生成气体的体积在标准状况下为nL,混合物中B的物质的量为_____mol(用含字母的代数式表示)。
②另取相同质量的该混合物,向其中加入足量的稀硫酸,固体全部溶解,生成气体的体积的标准状况下为mL,该反应中转移电子的物质的量为_____mol,原混合物中A的质量为__________g(用含字母的代数式表示)。
③向②所得的溶液中加入过量的氢氧化钠溶液,充分搅拌后,过滤,沉淀经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等,则原混合物中B的质量分数为_____。
氢元素与氮元素可组成多种微粒,如NH3、NH4+、N2H4等。
I.(1)分析常见的H2O与H2O2、CH4与C2H6的分子结构,写出的N2H4电子式_____。
(2)某盐N2H5Cl与NH4Cl类似,是可溶于水的离子化合物,其溶液因水解而呈弱酸性。N2H5Cl溶液显酸性原因(用离子方程式表示)_______________。
(3)有七种物质:NH3、Mn2O3、ZnCl2、MnO2、NH4Cl、Zn和H2O,是锌—锰电池中氧化还原反应的某些反应物(NH4Cl为其中之一)和某些生成物(NH3为其中之一)。
写出上述化学反应方程式:_________________________。 II.在恒温条件下,起始容积均为5L的甲、乙两密闭容器中(甲为恒容器、乙为恒压容器),均进行反应:N2+3H22NH3,有关数据及平衡状态特点见下表。
II.在恒温条件下,起始容积均为5L的甲、乙两密闭容器中(甲为恒容器、乙为恒压容器),均进行反应:N2+3H22NH3,有关数据及平衡状态特点见下表。
(4)下列能表明容器乙一定达平衡状态的是_____(填字母)
| A.容器内的混合气体的平均相对分子质量不再变化 | |
| B.容器内的氮元素的质量不再变化 | |
C.氢气的生成速率与氨气的消耗速率之比为2:3 |
D.形成1mol N N键的同时形成6molN—H键 |
(5)甲容器中氮气的转化率为_____。
(6)起始时,容器乙是容器甲压强的_____倍。
硫酸亚铁药片(外表包有一层特质的糖衣)是一种治疗铁性贫血的药剂。某化学课外活动小组为测定其中硫酸亚铁的含量,进行如下实验:
I.甲同学要测定其中铁元素含量,实验按以下步骤进行: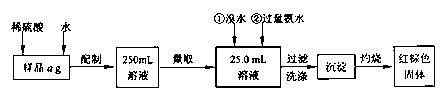
请根据上面流程,回答以下问题:
(1)刮除药片的糖衣,甲同学如下称得样品ag,则你认为a=_____。
(2)将其碾碎后迅速溶解,配制250mL溶液。配制溶液时除烧杯、玻璃棒、量筒、250mL容量瓶外,还必须有的玻璃仪器__________。
(3)洗涤沉淀的操作是_____________________________________________。
(4)将沉淀物加热,冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3g,据此结果,还应进行的操作是________________________________________。
根据测得的数据可计算出硫酸亚铁的含量。
II、乙同学根据反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O,采用滴定的方法测定其中硫酸亚铁的质量分数。
(5)取上述甲同学所配置的待测液25.00mL置于锥形瓶中,并将0.02mol/L KMnO4的标准溶液装入_____(“酸式”或“碱式”)滴定管中,调节液面至“0”刻度。
(6)滴定操作时,眼睛注视_________________________。
(7)滴定待测液至终点,如此滴定三次,实验数据如下表所示:
(其中第一次滴定给点的数据如右图,请你你读得的数据填入表中)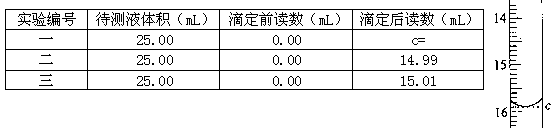
样品中硫酸亚铁的质量分数为_____。(保留3位有效数字)