( 10) 已知砒霜As2O3与Zn可以发生如下反应:As2O3+6Zn+6H2SO4===2AsH3↑+6ZnSO4+3H2O
(1)请用双线桥法标出电子转移的方向和数目。
_________________________________________________________。
(2)As2O3在上述反应中显示出来的性质是____________________。
| A.氧化性 | B.还原性 | C.酸性 | D.碱性 |
(3)该反应的氧化产物是__________,还原产物是________。
(4)若生成0.2 mol AsH3,则转移的电子数为_____________________。
氧化铝(Al2O3)和氮化硅(Si3N4)是优良的高温结构陶瓷,在工业生产和科技领域有重要用途。
(1)Al与NaOH溶液反应的离子方程式为 。
(2)下列实验能比较镁和铝的金属性强弱的是 (填序号)。
a.测定镁和铝的导电性强弱
b.测定等物质的量浓度的Al2(SO4)3和MgSO4溶液的pH
c.向0.1 mol/LAlCl3和0.1 mol/L MgCl2中加过量NaOH溶液
(3)铝热法是常用的金属冶炼方法之一。
已知:4Al (s)+3O2(g) =2Al2O3(s) ΔH1 =" -3352" kJ/mol
Mn(s)+ O2(g) =MnO2 (s) ΔH2 =" -521" kJ/mol
Al与MnO2反应冶炼金属Mn的热化学方程式是 。
(4)氮化硅抗腐蚀能力很强,但易被氢氟酸腐蚀,氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,其反应方程式为 。
(5)工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g) + 2N2(g) + 6H2(g)Si3N4(s) + 12HCl(g) △H<0
某温度和压强条件下,分别将0.3mol SiCl4(g)、0.2mol N2(g)、0.6mol H2(g)充入2L密闭容器内,进行上述反应,5min达到平衡状态,所得Si3N4(s)的质量是5.60g。
①H2的平均反应速率是 mol/(L·min)。
②若按n(SiCl4) : n(N2) : n(H2) =" 3" : 2 : 6的投料配比,向上述容器不断扩大加料,SiCl4(g)的转化率应 (填“增大”、“减小”或“不变”)。
(6)298K时,Ksp[Ce(OH)4]=1×10—29。Ce(OH)4的溶度积表达式为Ksp= 。
为了使溶液中Ce4+沉淀完全,即残留在溶液中的c(Ce4+)小于1×10-5mol·L-1,需调节pH为 以上。
()石墨在材料领域有重要应用,某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质,设计的提纯与综合利用工艺如下: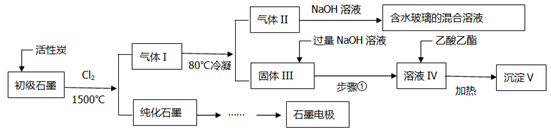
(注:SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃)
(1)向反应器中通入Cl2前,需通一段时间N2,主要目的是_________________。
(2)高温反应后,石墨中氧化物杂质均转变为相应的氯化物,气体I中的碳氧化物主要为________________________,由气体II中某物质得到水玻璃的化学反应方程式为_________________。
(3)步骤①为:搅拌、________、所得溶液IV中的阴离子有_______________。
(4)由溶液IV生成沉淀V的总反应的离子方程式为___________________,100kg初级石墨最多可获得V的质量为___________kg。
(5)石墨可用于自然水体中铜件的电化学防腐,完成下图防腐示意图,并作相应标注。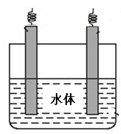
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00 %的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。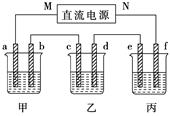
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为________极。
②电极b上发生的电极反应为 ___________________________________。
③列式计算电极b上生成的气体在标准状况下的体积: ___________________________________________________________。
④电极c的质量变化是________g;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液______________________________________________;
乙溶液______________________________________________;
丙溶液______________________________________________;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
_____________________________________________________________。
已知在25 ℃的水溶液中,AgX、AgY、AgZ均难溶于水,且Ksp(AgX)=1.8×10-10,Ksp(AgY)=1.0×10-12,Ksp(AgZ)=8.7×10-17。
(1)根据以上信息,判断AgX、AgY、AgZ三者的溶解度(已被溶解的溶质的物质的量/1 L溶液)S(AgX)、S(AgY)、S(AgZ)的大小顺序为_________________ _____________________________________________。
(2)若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-)________(填“增大”“减小”或“不变”)。
(3)在25 ℃时,若取0.188 g的AgY(相对分子质量188)固体放入100 mL水中(忽略溶液体积的变化),则溶液中Y-的物质的量浓度为________。
(4)由上述Ksp判断,在上述(3)的体系中,能否实现AgY向AgZ的转化,________(填“能”或“不能”),理由为_______________________________。
现有下列电解质溶液:
①Na2CO3②NaHCO3③ ④CH3COONH4⑤NH4HCO3
④CH3COONH4⑤NH4HCO3
(1)在这五种电解质溶液中,既能与盐酸又能与烧碱溶液反应的是(填写序号)________。
(2)已知酸性:H2CO3> >
> 。常温下,物质的量浓度相同的①②③溶液,pH由大到小顺序为(填序号)________>________>________。
。常温下,物质的量浓度相同的①②③溶液,pH由大到小顺序为(填序号)________>________>________。
(3)写出⑤与足量NaOH溶液混合加热反应的离子方程式: __________________________________________________________________。
(4)已知常温下CH3COONH4溶液呈中性,根据这一事实推测⑤溶液的pH________7(填“>”“=”或“<”),理由是________________________。