为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)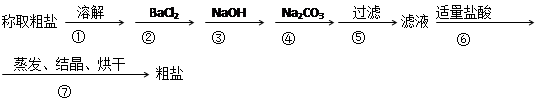
(1)判断BaCl2已过量的方法是
。
(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2)
。
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是
。
(4)为检验精盐纯度,需配制250 mL 0.2 mol/L NaCl(精盐)溶液,题图是该同学转移溶液的示意图,图中的错误是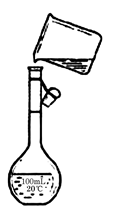
。
某同学在学习乙醇的知识后,设计了如下的实验。操作步骤为:
①在试管里加入2 mL 乙醇;
②把一端弯成螺旋状的铜丝放在酒精灯外焰中加热;
③立即将铜丝插入盛有乙醇的试管里(如图),反复操作几次;
④闻生成物的气味,观察铜丝表面的变化。
试回答下列问题:
⑴该实验的目的是;
⑵第④步操作中,能闻到气味;
⑶写出反应的化学方程式。
控制反应条件可改变化学反应速率。
(1)使用催化剂是改变化学反应速率的一种方法,例如H2O2在MnO2作用下分解,请写出该反应的化学方程式:_____________________________。
(2)经研究发现Fe3+和Cu2+对H2O2的分解也具有催化作用。
某研究小组为比较Fe3+和Cu2+对H2O2分解的催化效果,设计了如下实验,请将他们的实验方案补充完整:
实验目的:_________________________________-
实验试剂:5%H2O2溶液,0.1mol/LFeCl3溶液,0.1mol/LCuSO4溶液
实验仪器:试管、胶头滴管
实验步骤:取两支试管各加入1mL5%H2O2溶液,分别滴加两滴0.1mol/LFeCl3溶液、0.1mol/LCuSO4溶液。
该小组的同学可通过观察______________________以比较出Cu2+和Fe3+的催化效果。
问题与讨论:有同学提出将FeCl3改为Fe2(SO4)3更合理,你认为他的理由是____________________________________________________。
(3)影响化学反应速率的因素除催化剂外,还有______________(答出一种即可),并举一例生产、生活实例加以说明:__________________________。
人体必须的元素之一,海洋植物如海带、海藻中含有丰富的、以碘离子形式存在的碘元素。在实验室中,从海藻里提 取碘的流程和实验装置如下:
取碘的流程和实验装置如下: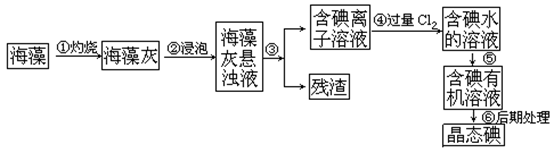
(1)指出上述提取碘的过程中有关实验操作的名称:步骤③______,步骤⑤______。
(2)写出步骤④对应反应的离子方程式:______________________________。
(3)提取碘的过程中,可供选择的有机试剂是_______________。
| A.酒精 | B.醋酸 | C.四氯化碳 | D.苯 |
(4)为了使海藻灰中的碘离子转化为碘的有机溶液,即完成步骤③至⑤,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网、以及必要的夹持仪器和物品,尚缺少的玻璃仪器是_________________________________________________________。
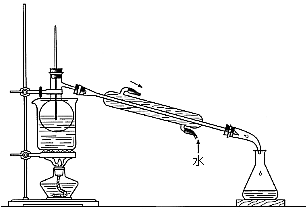
(5)从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏。指出下图实验装置中存在的错误之处: 。
。
|
实验室制取气体常用的装置如下列图示,请回答下列问题:(选用装置时填字母编号)

 ______________________,
______________________,
 满的方法:____________________________________________________;
满的方法:____________________________________________________;
下图表示配制 100 mL 0.100 mol·L-1 Na2CO3溶液的几个关键实验步骤和操作,据图回答下列问题: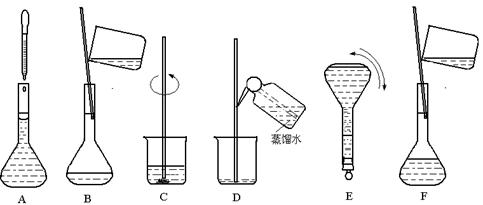
(1)步骤E中将一玻璃仪器上下颠倒数次,该仪器的名称是。
(2)步骤B通常称为转移,步骤A通常称为 。
。
(3)将上述实验步骤A→F按实验过程先后次序排列。