(3分).选择萃取剂将碘水中的碘萃取出来,这种萃取剂应具备的性质是____________.
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯。回答下列问题: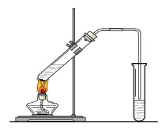
(1)写出制取乙酸乙酯的化学反应方程式: 。
(2)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法(加入试剂顺序)是:。
(3)浓硫酸的作用是:①;②。
(4)饱和碳酸钠溶液的主要作用是
。
(5)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止 。
(6)若要把制得的乙酸乙酯分离出来,应采用的实验操作是
(1)元素周期表有______个周期,每一周期中元素原子的_______________相同,从左到右元素的金属性_________(填增强或减弱);元素周期表中有________列,第ⅥA族处在第_________列,同一主族从上到下,元素的非金属性依次_________(填增强或减弱)。
(2)下列物质中:互为同素异形体的有(填序号,下同),属于同位素的有,属于同一种物质的有,属于同分异构体的有。
①液氯② Cl ③白磷④氯气⑤红磷
Cl ③白磷④氯气⑤红磷
⑥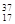 Cl⑦正丁烷⑧异丁烷
Cl⑦正丁烷⑧异丁烷
A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和A与X均可形成10个电子化合物;B与Z的最外层电子数之比为2︰3,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红。请回答下列问题。
(1) X在周期表中的位置是__________________________
(2) 化合物Y2X2的电子式为;它含有的化学键类型有(填序号)。
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(3) A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应生成Z的化学方程式为_____________________________________。
(4) A的单质与X的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正、负极电极反应式为_________________________,________________________。
(5) 写出化合物Y2X2与水反应的离子方程式_____________________。
(6) B的最高价氧化物的结构式为_______________________________。
指出下列反应的反应类型。
(1)CH2===CH2+Br2―→CH2BrCH2Br,反应类型:__________。
(2)CH3CH3+2Cl2 CH2ClCH2Cl+2HCl反应类型:________。
CH2ClCH2Cl+2HCl反应类型:________。
(3)C2H4+3O2 2CO2+2H2O,反应类型:___________。
2CO2+2H2O,反应类型:___________。
用下列:①H2O②H2O2③Ba(OH)2④Na2O2⑤Cl2⑥Ar⑦CO2等物质填空。(填序号)
(1) 由离子键和非极性键构成的是
(2) 由极性键和非极性键构成的是
(3) 不存在化学键的是
(4) 共价化合物有
(5) 含有极性共价键的离子化合物的是