非金属元素H、C、N、O、S、Cl能形成的化合物种类很多,单质及化合物的用途很广泛,完成下列各题。
(1)①O2-的核外电子排布式为 ,CS2的晶体类型为 晶体,其C的轨道杂化方式为 ;
②CH3OH在常温下为液态,沸点高于乙烷的主要原因是 ;
(2)Cl2是一种大气污染物,液氯储存区贴有的说明卡如下(部分):
| 危险性 |
 |
| 储运要求 |
远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
| 泄漏处理 |
NaOH、NaHSO3溶液吸收 |
| 包装 |
钢瓶 |
①用离子方程式表示“泄漏处理”中NaHSO3溶液的作用 。
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是 。
③将Cl2通入适量KOH溶液中,产物中可能有KCl、KClO、KClO3。当溶液中c(Cl-):c(ClO-)=11:1时,则c(ClO-):c(ClO3-)比值等于
(3)室温时,向100mL 0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。分析图中a、b、c、d四个点,水的电离程度最大的是 ;在b点,溶液中各离子浓度由大到小的排列顺序是 。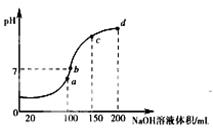
(10分)下表中实线是元素周期表的部分边界,其中上边界并未用实线画出。
根据信息回答下列问题:
(1)基态Ga原子的最外层电子排布式为_________________
(2)铁元素位于元素周期表的__________区;Fe和CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为__________。
(3)已知:原子数目和价电子总数均相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO互为等电子体的分子和离子分别为__________和__________(填化学式)。
(4)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有__________。
(5)根据VSEPR模型预测ED4-的空间构型为__________。B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子为__________(写2种)。
(9分)钛已作为常用金属铁、铝后的第三金属,我国钛矿储量丰富,对它的应用研究是目前科学研究的前沿课题之一。
(1)请写出铝原子的基态电子排布式:________。
(2)X+、Y2-、Z-与Al3+具有相同的电子层结构,则下列说法正确的是________。
| A.元素第一电离能:X>Al |
| B.电负性:Z>Y |
| C.氢化物稳定性:H2Y>HZ |
| D.H2Y中Y的杂化类型是sp3,键角小于109.5° |
(3)某钙钛型复合氧化物晶胞结构如图①所示,以A原子为晶胞顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Ti、Fe时,这种化合物具有磁电阻效应。该钙钛型复合氧化物的化学式为________。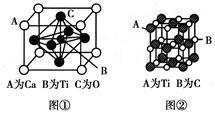
(4)最近发现钛(Ti)原子和碳原子可构成气态团簇分子,分子模型如图②所示。该气态团簇分子的分子式为________,它属于________晶体,其主要物理性质有________(写出两点即可)。
如图所示是一些晶体的结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分。
(1)其中代表金刚石的是(填写编号字母,下同) ,其中每个碳原子与 个碳原子最接近且距离相等。
(2)其中代表石墨的是 ,其中每个正六边形占有的碳原子数平均为 个。
(3)其中表示NaCl的是 ,每个钠离子周围与它最接近且距离相等的氯离子有 个,每个钠离子周围与它最接近且距离相等的钠离子有 个,每个氯离子周围紧邻的钠离子相连接而成的空间几何体为 。
(4)代表CsCl的是 ,它属于 晶体,每个铯离子与 个氯离子紧邻.
下图中X是一种具有水果香味的合成香料,A是直链有机物,E与FeCl3溶液作用显紫色。请根据上述信息回答:
请回答下列问题:
(1)H中含氧官能团的名称是 。B→I的反应类型为 。
(2)只用一种试剂鉴别D、E、H,该试剂是 。
(3)D和F反应生成X的化学方程式为 。
下列是有机化学中的反应类,回答下列问题
①由乙炔制氯乙烯 ②用甲苯制三硝基甲苯 ③乙烯使溴的四氯化碳溶液褪色
④甲苯使酸性高锰酸钾溶液褪色 ⑤由乙烯制聚乙烯 ⑥甲烷与氯气在光照的条件下反应
(1)写出①②⑤的反应方程式: 、 、 .
(2)①~⑥中属于取代反应的是(填序号下同) ;属于氧化反应的是 ;属于加成反应的是 。