根据下列反应的化学方程式,判断有关物质的还原性强弱顺序是
I2+SO2+2H2O H2SO4+2HI 2FeCl2+Cl2
H2SO4+2HI 2FeCl2+Cl2 2FeCl3
2FeCl3
2FeCl3+2HI 2FeCl2+2HCl+I2
2FeCl2+2HCl+I2
| A.I->Fe2+>Cl->SO2 | B.Cl->Fe2+>SO2>I- |
| C.Fe2+>I->Cl->SO2 | D.SO2>I->Fe2+>Cl- |
在pH=1的无色溶液中,可以大量共存的一组离子是
| A.NH4+、NO3- 、K+、SO42- | B.Cl-、NO3-、HCO3-、Na+ |
| C.Na+、ClO-、S2-、NO3- | D.MnO4-、K+、Na+、SO42- |
利用下列各组中的物质制备并收集相应的气体,能采用如图所示装置的是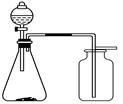
| A.浓氨水和固体NaOH制NH3 |
| B.过氧化氢溶液和二氧化锰制O2 |
| C.稀硝酸和铜片制NO |
| D.电石和饱和食盐水制乙炔 |
下列说法不正确的是
| A.Al2O3、SiC等是耐高温材料 |
| B.将Cl2通入冷的消石灰中可制得漂白粉 |
| C.浓硫酸可用于干燥NH3、SO2、NO2等气体 |
| D.硅酸钠的水溶液是制备硅胶和木材防火剂的原料 |
下列实验装置、试剂选用或操作正确的是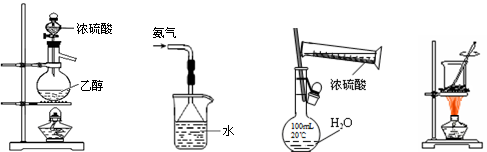
| A.实验室制乙烯 | B.用水吸收氨气 | C.稀释浓硫酸 | D.海带灼烧成灰 |
下列化学表达方式不正确的是
| A.中子数为20的氯原子:37Cl |
B.S2-的结构示意图: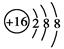 |
C.CCl4的电子式: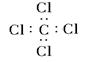 |
D.2-甲基丁烷的结构简式: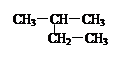 |