、氢氧燃料电池是符合 绿色化学理念的新型发电装置。
绿色化学理念的新型发电装置。
下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
(1)氢氧燃料电池的能量转化主要形式是 ,
在导线中电子流动方向为 (用a、b 表示)。
(2)负极反应式为 。
(3)电极表面镀铂粉的原因为
。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续
不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:Ⅰ. 2Li + H2  2LiH Ⅱ. LiH + H2O ="=" LiOH + H2↑
2LiH Ⅱ. LiH + H2O ="=" LiOH + H2↑
①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
②已知LiH固体密度约为0.8g/cm3。用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol。
烯烃在一定条件下氧化时,由于C=C键断裂,转化为醛、酮,如: 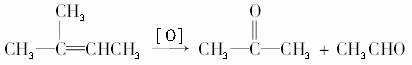
(1)若 在上述类似条件下发生反应,写出反应的方程式。______________________________________________
在上述类似条件下发生反应,写出反应的方程式。______________________________________________
(2)已知某烃(C7H12)在上述条件下反应后,生成两种有机物 ,
, ,试写出该烃的结构简式。_______________________
,试写出该烃的结构简式。_______________________
下列有机物有多个官能团: 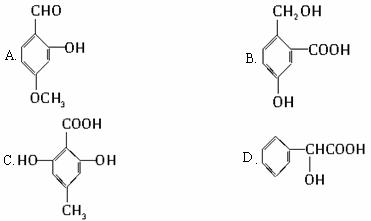
E.CH2=CHCOOCH=CHCOOCH=CH2
(1)可以看作醇类的是(填入编号)__________________。
(2)可以看作酚类的是__________________。
(3)可以看作羧酸类的是__________________。
(4)可以看作酯类的是___________________。
相同质量的钠、镁、铝分别跟足量稀硫酸反应,在同温、同压下产生气体的体积比为__________;如果这三种金属各取等物质的量,也分别跟足量稀硫酸反应,在同温同压下产生气体的体积比为_________________。
按体积比为4:2:3所组成的N2、O2、CO2,混合气体100g在标准状况下体积为___L。
某学生试图用电解法根据电极上析出物质的质量来验证阿伏加德罗常数值,其实验方案的要点为:
①用直流电电解氯化铜溶液,所用仪器如下图。
②强度为I A,通电时间为t s后,精确测得某电极上析出的铜的质量为m g。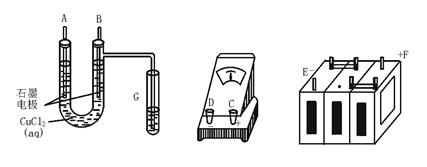
试回答:
(1)这些仪器的正确连接顺序为(用图中标注仪器接线柱的英文字母表示,下同)
E接____________,C接____________,____________接F。
实验线路中的电流方向为________→_______→________→C→________→________
(2)写出B电极上发生反应的离子方程式____________,G试管中淀粉KI溶液变化的现象为____________,相应的离子方程式是____________。
(3)为精确测定电极上析出铜的质量,所必需的实验步骤的先后顺序是____________。
①称量电解前电极质量 ②刮下电解后电极上的铜并清洗 ③用蒸馏水清洗电解后电极 ④低温烘干电极后称量 ⑤低温烘干刮下的铜后称量 ⑥再次低温烘干后称量至恒重
(4)已知电子的电量为1.6×10-19 C。试列出阿伏加德罗常数的计算表达式:NA=____________。