在金属晶体中存在的粒子是____________和____________.通过______________形成的单质晶体叫做金属晶体
“用微观的眼光看世界”是我们学习化学的重要思想方法。试根据以下材料,结合你所学过的知识,简要回答:
材料一:一滴水里大约有15万亿个水分子,如果10亿人来数一滴水里的水分子,每人每分钟数100个,日夜不停,需要数3万年才能数完。
材料二:大多数物质都有热胀冷缩现象。
材料三:湿衣服在夏天比冬天容易干。
(1)材料一说明:______________________。
(2)材料二说明:____________________________________。
(3)材料三说明:________________________________________________。
在宏观、微观和符号之间建立联系是化学学科特点。
(1)在水、铜、氯化钠3种物质中,由离子构成的是__________。
(2)萨罗(Salol)是一种消毒剂,其分子模型如图所示:
该物质的一个分子中含有_________个原子;萨罗(Salol)中氢元素与氧元素的质量比为________。
(3)在某原子的结构示意图中 ,其中y=。
,其中y=。
(4)A、B、C、D表示4种物质,部分物质的微观示意图见下表。A和B在一定条件下反应生成C和D。
请回答以下问题:
①B、C、D中属于单质的是_____________。(填字母序号,下同);属于氧化物的是_____________。
水是生命之源、万物之基,是人类宝贵的自然资源,我们每个人都要关心水、爱护水、节约用水。
(1)我国规定生活饮用水的水质必须达到以下指标:
a.不得呈现异色 b.不得有异味 c.应澄清透明
其中“ab”指标可以通过加入_______达到,“c”指标可以通过________操作达到。
(2)凉开水不宜养鱼,其主要原因是凉开水中几乎不含_______________。
①氧元素②水分子③氧原子④氧分子
(3)节约用水、防治水污染应成为我们的自觉行动,下列有关叙述不正确的是___。
A、生活中应养成良好的用水习惯,尽可能利用每一滴水
B、工业废水经过处理达标后再排放
C、水体污染会危害人体健康
D、大量使用农药、化肥、不会造成水体污染
(4)区分软水和硬水常规用的物质是_______________。
(5)如图所示:是水的电解实验,试管1中收集的气体是_______________。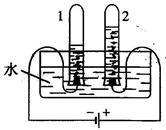
(6)下列反应中,不能用来确定水由氢、氧元素组成的是_______________。
A、H2和O2反应 B、电解水
C、H2和CL2反应 D、H2和CuO反应
请用化学用语填空。
(1)硫酸根离子:_______________。
(2)过氧化氢的化学式是:_______________。
(3)8个水分子:_______________。
(4)标出五氧化二磷中磷元素的化合价:_______________。
化学实验小组讨论测定双氧水溶液中过氧化氢的物质的量和体积。
[查阅资料]:常温下氧气密度为1.42 g/L;碱石灰干燥剂是氧化钙和固体氢氧化钠的混合物,极易吸收水蒸汽和二氧化碳。
A B C
[设计原理]:将一定质量的双氧水样品与二氧化锰混合,测定反应产生的氧气的质量,计算出其中过氧化氢的质量,从而可知双氧水溶液中过氧化氢的物质的量。
[过程方法]:
组长首先设计(如图A):向装有样品溶液的锥形瓶中投入二氧化锰,待双氧水完全反应完毕后测得产生氧气的质量是6.4g,则制取氧气为mol,双氧水溶液含过氧化氢mol(写出具体计算过程)
小林对组长的图A设计提出质疑,设计了如图B的方案,即在组长方案的锥形瓶上加一装有碱石灰干燥管,然后再操作,请说明小林质疑的理由是。
若用C来制取氧气并测得氧气的体积,则氧气的体积约等于