有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种粒子,分别属于同一氧化还原反应中的反应物和生成物,下列叙述正确的是
| A.还原剂与氧化剂的物质的量之比为1︰8 |
| B.若把该反应设计为原电池,则负极反应为Fe2+-e-=Fe3+ |
| C.若有lmolNO3-发生氧化反应,则转移8mole- |
| D.该过程说明Fe( NO3)2溶液不宜加酸酸化 |
某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中p表示压强,T表示温度,n表示物质的量):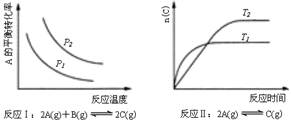
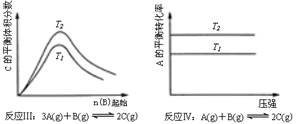
根据以上规律判断,下列结论正确的是( )
| A.反应Ⅰ:△H>0,p2>p1 | B.反应Ⅱ:△H<0,T1>T2 |
| C.反应Ⅲ:△H>0,T2>T1;或△H<0,T2<T1 | D.反应Ⅳ:△H<0,T2>T1 |
下列各溶液中,微粒的物质的量浓度关系正确的是:
A.10mL0.5mol/LCH3COONa溶液与6mL1mol/L盐酸混合:
c(Cl-)>c(Na+)>c(H+)>c(OH-)
B.0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C.在NaHA溶液中一定有:c(Na+) + c(H+) =c(HA-) + c(OH-) + c(A2-)
D.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:
c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl)
美国梅奥诊所的研究人员最近发现,绿茶中含有EGCG(表没食子儿茶素没食子酸酯)物质具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知EGCG的结构如右图: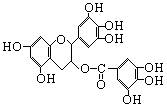
有关EGCG的说法正确的是
| A.EGCG能与碳酸钠溶液反应放出二氧化碳 |
| B.EGCG遇FeCl3溶液能发生显色反应 |
| C.1molEGCG最多可与含10mol氢氧化钠的溶液完全作用 |
| D.EGCG在空气中易被氧化 |
下列实验不能达到预期目的的是
| 序号 |
实验操作 |
实验目的 |
| A |
浓、稀HNO3分别与Cu反应 |
比较浓、稀HNO3的氧化性强弱 |
| B |
MgCl2、AlCl3溶液中分别滴加NaOH溶液至过量 |
比较镁、铝的金属性强弱 |
| C |
测定等浓度的NaCl、Na2SO4两溶液的PH |
比较氯、硫的非金属性强弱 |
| D |
用等浓度的盐酸、碳酸氢钠两溶液混合反应 |
比较盐酸、碳酸的酸性强弱 |