分类是重要的科学研究方法,下列物质归类不正确的是
| A.混合物:水煤气、石油裂解气、漂粉精、铝热剂 |
| B.电解质:明矾、石墨、冰醋酸、硫酸钡 |
| C.化合物:干冰、烧碱、冰水混合物、胆矾 |
| D.能用启普发生器或其简易装置制取的有 |
下列有关试剂的保存方法正确的是
| A.NaOH固体保存在配有橡皮塞的细口瓶中 |
| B.氯水或硝酸银溶液存放在配有磨口塞的棕色玻璃瓶中 |
| C.浓硫酸放在有软木塞的玻璃瓶中 |
| D.Na2CO3溶液用容量瓶长期存放 |
下列有关化学表述正确的是
A.羟基的电子式: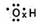 |
B.次氯酸的电子式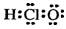 |
C.核内有8个中子的碳原子: |
D.乙酸分子的比例模型: |
只需一滴,清水就能变高汤——一种颇为神奇的食品添加剂名为“一滴香”,在媒体广受关注。下列观点正确的是
| A.食品添加剂,通常应提倡多加 |
| B.食品添加剂有害人体健康,应该禁止使用 |
| C.食品添加剂用得恰当,对人体不造成伤害 |
| D.化学融入烹饪学,是人类文明的退步 |
由于实验误差,确定 物质的组成和结构时,常常需要将多个实验进行对照和分析才能得出正确结论。已知某脂肪酸(用R表示)有以下实验记录:
物质的组成和结构时,常常需要将多个实验进行对照和分析才能得出正确结论。已知某脂肪酸(用R表示)有以下实验记录:
| 组成元素 |
官能团 |
相对分子质量 |
与碱反应 |
加成反应 |
| C、H、O |
羧基、碳碳双键 |
小于300 |
2.493gR可被 0.500gKOH中和 |
1.247gR可与2.250g I2反应 |
则以下关于R的结论肯定正确的是
A.R是一元羧酸 B.R分子含一个碳碳双键
C.R的相对分子质量约为278D.R的分子式为C18H32O2